Термодинамічні процеси
Зміна стану термодинамічної системи при взаємодії з навколишнім середовищем називається термодинамічним процесом. Розрізняють такі процеси:
1. Процес, при протіканні якого відбувається нескінченно мале відхилення системи від стану рівноваги, називається рівноважним.
2. Процес, при протіканні якого система не знаходиться в стані рівноваги – нерівноважний.
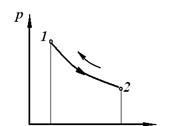
3. Процес, який протікає як у прямому, так і у зворотному напрямі без якихось залишкових змін в навколишньому середовищі, називається зворотним.
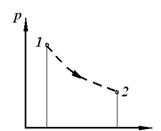
4. Процес, що протікає як в прямому, так і у зворотному напрямі і при якому система не повертається в початкове положення, називається незворотним. Причини незворотності: наявність сил тертя і кінцевих температур між тілами.
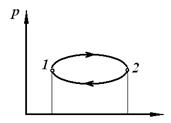
5. Якщо система, вийшовши з деякого стану 1, приходить у стан 2 по одному шляху, а приходить в стан 1 по іншому шляху (повертається), то такий процес називається круговим (циклом).
| 
| 
|
| v1 v2 v | v1 v2 v | v1 v2 v |
| Обернений процес | Необернений процес | Круговий процес (цикл) |
Газові суміші
Суміші газів служать робочими тілами в багатьох процесах і установках. Вони підкоряються закону Дальтона:
Тиск в суміші Рсум. дорівнює сумі парціальних тисків його компонентів Рi.:
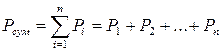 ,
,
де n – число компонентів,
i - і-тий компонент,
Р1, Р2, Рn – парціальні тиски компонентів.
Склад газових сумішей задається:
1. Масовими частками – відношення маси компоненту до маси суміші
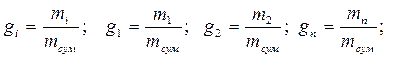
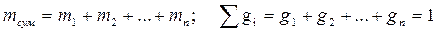
2. Об'ємними частками – відношення приведеного об'єму Vi компоненту до об'єму всієї суміші:
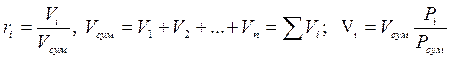
3. Мольними частками – відношення числа молів компоненту до сумарної кількості молів усіх компонентів.
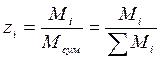 ,
,
для ідеальної газової суміші 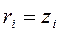 .
.
Уявна молярна маса суміші – відношення маси суміші до сумарної кількості молей:
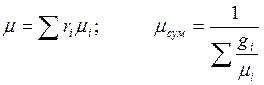
Газова стала суміші
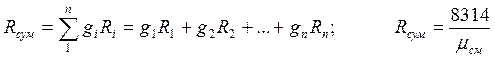
Зв'язок між об'ємними і масовими частками:
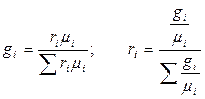
Парціальний тиск суміші
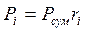
Дата добавления: 2020-02-05; просмотров: 973;











