СОСТАВ И ХАРАКТЕРИСТИКА ПРИРОДНЫХ ВОД
1.Под качеством природной воды понимают совокупность ее свойств, обусловленных характером и концентрацией содержащихся в воде примесей. Примеси природных вод подразделяются на неорганические и органические. Отдельную группу примесей составляют микрофлора и микрофауна природных водоемов, оказывающая существенное влияние на качество воды.
При оценке качества природной воды с точки зрения возможности ее обработки теми или иными способами имеет значение не только природа примесей, но и их физико-химическое состояние. Классификация примесей на основе их фазово-дисперсной характеристики разработана под руководством акад. Л. А. Кульского. Согласно этой классификации, примеси природных вод по их физико-химическому состоянию, которое в значительной степени определяется дисперсностью веществ, могут быть разделены на четыре группы.
К первой группе примесей относятся взвешенные вещества (взвеси) - суспензии и эмульсии, средний размер частиц которых составляет 10-3—10-5 см. Состав примесей этой группы очень разнообразен: это частицы глины и песка, малорастворимые гидроокиси металлов, частицы ила, эмульсии минеральных масел, нефтепродукты, планктон (в том числе и бактериальный).
В совокупности эти примеси обусловливают мутность воды. Более полное представление о составе примесей первой группы можно получить на основе химического, гидробиологического и бактериологического анализов. Для этого обычно определяют взвешенные вещества и их зольность, качественный и количественный состав гидробионтов, микробное число и число бактерий группы кишечной палочки.
Ко второй группе относятся коллоидно-растворенные примеси и высокомолекулярные органические соединения со степенью дисперсности 10-5—10-6 см.
Высокомолекулярные соединения могут образовывать не только коллоидные, но и истинные растворы. Тем не менее, они отнесены ко второй группе примесей, так как размер их частиц соответствует коллоидной степени дисперсности и по ряду свойств растворы этих веществ сходны с коллоидными системами.
 К примесям этой группы относятся минеральные и органо-минеральные частицы почв и грунтов, коллоидные соединения железа и гумус, образующийся в результате химического и биохимического разложения растительных остатков непосредственно в водоеме и попадающий в него с атмосферными и талыми водами из почвы.
К примесям этой группы относятся минеральные и органо-минеральные частицы почв и грунтов, коллоидные соединения железа и гумус, образующийся в результате химического и биохимического разложения растительных остатков непосредственно в водоеме и попадающий в него с атмосферными и талыми водами из почвы.
В составе гумусовых веществ этой группы различают коллоидные соединения гуминовых кислот и фульвокислот. Перечисленные соединения придают воде цветность. Наличие коллоидных примесей увеличивает и мутность воды, хотя на показатель взвешенных веществ влияния не оказывает, так как частицы коллоидной степени дисперсности не задерживаются фильтром.
Третью группу примесей составляют молекулярно растворенные вещества с размером частиц 10-б—10-7 см.
Растворенные газы, главным образом кислород и углекислый газ, практически всегда содержатся в природной воде. В некоторых подземных водах и загрязненных поверхностных источниках может присутствовать сероводород.
К растворенным органическим соединениям относятся продукты жизнедеятельности и разложения бактерий, актиномицетов, плесеней, водорослей, макрофитов и других водных организмов, а также фенолы и истинно растворенные фульвокислоты. Содержание органических веществ может увеличиваться при спуске в водоем недостаточно очищенных бытовых и производственных сточных вод.
В связи с невозможностью индивидуального аналитического определения всех присутствующих в воде органических соединений прибегают к суммарной оценке их содержания по величине окисляемости, интенсивности запаха и привкуса и т. д.
Таким образом, примеси третьей группы существенно влияют на качество воды, изменяя ее органолептические показатели и увеличивая окисляемость. Некоторые окрашенные молекулярно растворенные органические соединения обусловливают цветность воды.
Четвертая группа примесей представлена веществами, диссоциирующими в воде на ионы, со степенью дисперсности менее 10-7 см. Это главным образом соли, концентрация которых определяет степень минерализации воды.
Общее содержание солей в воде приближенно оценивают по величине плотного остатка, под которым подразумевается сумма всех примесей воды, определяемая путем выпаривания и последующего высушивания предварительно профильтрованной пробы.
В практике водоподготовки плотный остаток обычно называют сухим остатком, хотя последний определяется из нефильтрованной пробы, и таким образом в его состав входят все примеси, в том числе и нерастворенные. Такое смешение общепринятых понятий неверно, но оправдывается тем, что в маломутных, а тем более в питьевых водах результаты обоих определений очень близки, поскольку содержание взвеси в этих водах невелико, а величина плотного остатка значительна.
Более полное представление о составе примесей четвертой группы дает изучение ионного состава воды. Для подавляющего большинства природных вод общее солесодержание достаточно точно определяется катионами Са2+, Mg2+, Na+, K+ и анионами НСО-, SC2-4, Cl-. Остальные ионы обычно присутствуют в очень незначительных количествах, но могут существенно влиять на свойства и качество воды.
Вода электронейтральна, поэтому суммы концентраций катионов и анионов, выраженные в мг-экв/л, равны. Учитывая преобладание в природных водах перечисленных семи ионов, можно записать:
[Са2+]+[[Mg2+] +[Na+]+[К+] = [НС03-]+ [SO2-4 ] +[Сl-].
Соотношение содержания отдельных ионов в природной воде зависит от общего солесодержания. Маломинерализованные воды рек и пресные артезианские воды содержат преимущественно катионы кальция и анионы НСO3 .По мере повышения минерализации содержание Na+, K+, SO2-4, Cl- в воде увеличивается. Суммарная концентрация катионов кальция и магния, выраженная в мг-экв/л, определяет общую жесткость воды.
Ионный состав воды обусловливает один из важнейших показателей ее качества — щелочность. Общая щелочность определяется суммой анионов слабых кислот, способных реагировать с соляной или серной кислотой. Общая щелочность в зависимости от ионного состава воды включает бикарбонатную, карбонатную, гидратную составляющие. Поскольку из перечисленных анионов в большинстве природных вод преобладает анион НСО3-, их щелочность определяется концентрацией бикарбонатов. Однако это справедливо при условии, что величина рН не превышает 8,4. При более высоких значениях рН (от 8,4 до 12) бикарбонатная щелочность постепенно уменьшается при одновременном увеличении карбонатной щелочности. При значениях рН>12 бикарбонатная щелочность равна нулю, так как в этих условиях углекислота в растворе присутствует только в виде карбонат-ионов. В водах со значениями рН>9 следует учитывать и гидратную составляющую общей щелочности.
Данные анализов ионного состава воды удобно изображать графически. Для этого в определенном масштабе на двух параллельных соприкасающихся полосах в порядке, указанном на рис. 1, откладывают концентрации катионов и анионов в мг-экв/л. Графическое изображение результатов анализа позволяет представить гипотетический состав солей в воде. Например, в воде, по результатам анализа корой составлена диаграмма, приведенная на рис. 1, в, гипотетически присутствуют Ca(HCO3)2, Mg(HC03)2, NaHC03, Na2S04, NaCl, KCl. При известных концентрациях катионов и анионов можно вычислить и концентрации этих солей.
а)
| Ca2+ | Mg2+ | Na+ + K+ | ||
| HC03- | S042- | Cl- | ||
б)
| Ca2+ | Mg2+ | Na+ | |
| HC03- | S042- | Cl- | |
в)
| Ca2+ | Mg2+ | Na+ | K+ | ||
| HC03- | S042- | Cl- | |||
Рис. 1 Диаграмма гипотетического состава солей в воде
Анионы на диаграмме располагаются в порядке увеличения их кислотных свойств. Расположение катионов обусловлено тем порядком, в котором они будут образовывать малорастворимые соединения при постепенном увеличении значения рН. Именно такой прием обработки, т. е. увеличение щелочности среды, лежит в основе процессов реагентного умягчения, обезжелезивания воды аэрацией или известкованием.
Огромное влияние на качество и свойства воды оказывают соединения угольной кислоты. Вместе с ионами кальция они образуют карбонатно-кальциевую систему равновесий, самую сложную в природных водах.
Из рис. 2 видно, что с карбонатно-кальциевой системой непосредственно связаны ионы водорода, и, таким образом, количественные соотношения между отдельными компонентами системы зависят от величины рН.
В условиях равновесия определенной концентрации бикарбонатов соответствует определенное количество свободной углекислоты, называемой равновесной. Вода при этом стабильна, так как не происходит ни выпадения карбонатов, ни их дополнительного растворения.
Если количество растворенной углекислоты больше ее равновесной концентрации, равновесие реакции (7) на рис. 2 сдвинется вправо, что приведет к растворению СаСОз. Избыток СО2сверх равновесной концентрации называется агрессивной углекислотой.
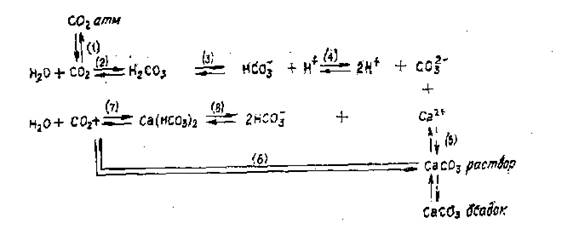 |
Рис. 2. Карбонатно-кальциевая система равновесий в природных водах
Контакт агрессивной воды с бетонными сооружениями приводит к вымыванию из них карбоната кальция.
Принедостатке СO2 по сравнению с равновесной концентрацией реакция (7) протекает справа налево, что приводит к дополнительному образованию и выпадению в осадок малорастворимого карбоната кальция.
Стабильность воды может быть оценена экспериментально или путем вычисления индекса насыщения воды карбонатом кальция по результатам определения в воде температуры, общего солесодержания, концентрации ионов кальция и общей щелочности. Основным и более точным методом является экспериментальный. Суть его состоит в определении общей щелочности или величины рН в исходной пробе и после встряхивания ее с карбонатом кальция в течение 1—2 ч.
Таким образом, качество природных вод оценивается комплексом различных химических, физико-химических, санитарно-бактериологических и гидробиологических показателей, определяемых соответствующим анализом.
2. Пригодность того или иного источника для целей водоснабжения определяется на основании данных его санитарного обследования с учетом результатов гидрогеологических, гидрологических, топографических изысканий.
Вода источников водоснабжения не должна содержать нежелательных примесей, которые не могут быть удалены современными методами обработки, а концентрация загрязнений, поддающихся устранению, должна соответствовать эффективности применяемых методов обработки.
Согласно ГОСТ 2874—73 в воде источников водоснабжения нормируется содержание хлоридов (не более 350 мг/л) и сульфатов (не более 500 мг/л) при общем солесодержании не более 1000 мг/л по плотному остатку. По согласованию с органами санитарно-эпидемиологической службы в исключительных случаях допускается использование воды источников с солесодержанием до 1500 мг/л. Кроме того, в воде источников водоснабжения нормируется содержание веществ, токсичных для человека.
Допустимый коли-индекс воды источников водоснабжения зависит от способа ее очистки. Если намечается только хлорирование, коли-индекс должен быть не более 1000, а при полной очистке воды — не более 10 000.
При несоответствии качества воды требованиям ГОСТ 2761 — 57 по тем или иным показателям, а также при содержании кишечных палочек более 10 000 в 1 л должна быть обеспечена дополнительная обработка воды, гарантирующая требуемое качество питьевой воды.
Качество питьевой воды регламентируется ГОСТ 2874—73. Нормирование концентрации тех или иных веществ обусловлено необходимостью обеспечения благоприятных органолептических свойств питьевой воды, безвредности ее химического состава и безопасности воды в санитарном отношении. Несоответствие хотя бы одного из этих нормативов требованиям ГОСТ 2874—73 дает основания для признания непригодности воды для питьевых целей.
Для всех нормируемых веществ определен лимитирующий показатель вредности — органолептический или санитарно-токсикологический. Например, железо даже в больших концентрациях не оказывает токсического действия на организм человека, но придает воде желто-бурую окраску и металлический привкус, если его концентрация превышает 0,3 мг/л. Лимитирующим показателем вредности для соединений железа является органолептический. То же самое можно сказать о хлоридах, сульфатах, марганце. Напротив, такие химические вещества, как соединения стронция, нитраты, не изменяя органолептических свойств воды, оказываются токсичными для человека. Например, стронций в концентрациях более 2 мг/л подавляет активность многих ферментов. В то же время горько-вяжущий привкус у воды появляется только при концентрации стронция 12 мг/л. Для таких соединений лимитирующим показателем вредности является санитарно-токсикологический.
К числу органолептических показателей качества воды относятся запах, привкус, мутность, цветность. Последние два показателя относятся к органолептический, хотя определяются физическими методами, поскольку они, так же как запах и привкус, приобретают значение при оценке качества воды лишь в меру восприятия органами чувств человека. Органолептические свойства воды нормируются: 1) по интенсивности допустимого изменения органолептических показателей (табл. 1); 2) по содержанию химических веществ, вредность которых определяется их способностью в минимальных концентрациях ухудшать органолептические показатели воды (табл. 2).
Таблица 1
| Показатель | Норма | |||||
| Запах при 20° С и при подогревании до 60° С, баллы, не более Привкус при 20° С, баллы, не более Цветность по платино-кобальтовой или имитирующей шкале, град, не более Мутность по стандартной шкале, мг/л, не более | ||||||
| 1,5 |
Таблица 2
| Показатель | Норма |
| Плотный остаток, мг/л | |
| Хлориды (С1-), мг/л | |
| Сульфаты (S042-),мг/л | |
| Железо (Fe2+, Fe3+), мг/л | 0,3 |
| Марганец (Мn2+), мг/л | 0,1 |
| Медь (Сu2+), мг/л | |
| Цинк (Zn2+), мг/л | |
| Остаточный алюминий (А13+), мг/л | 0,5 |
| Гексаметафосфат (в пересчете на РО4), мг/л | 3,5 |
| Триполифосфат (в пересчете на РО4), мг/л | 3,5 |
| Общая жесткость, мг-экв/л |
Согласно ГОСТ 2874—73, интенсивность специфических привкусов и запахов, появляющихся после хлорирования или любой другой реагентной обработки воды, должна быть не более 1 балла, т. е. запах и привкус может быть обнаружен только опытным аналитиком.
Безвредность химического состава питьевой воды (санитарно-токсикологический показатель) обеспечивается нормированием веществ: а) встречающихся в природных водах, таких, как соединения бериллия, молибдена, мышьяка, стронция и т.д.;
б) добавляемых к воде в процессе ее обработки реагентами, например, полиакриламидом (ПАА); в) появляющихся в результате промышленного и сельскохозяйственного загрязнения водоисточника нефтепродуктами, пестицидами и другими веществами.
Предельно допустимые концентрации (ПДК) для веществ, указанных в пп. «а» и «б», приведены в табл. 3. Вещества, названные в п. «в», нормируются «Правилами охраны поверхностных вод от загрязнения сточными водами».
Таблица 3
| Химическиевещества | пдк, мг/л | Химические вещества | ПДК,мг/л |
| Бериллий | 0,0002 | Селен | 0,001 |
| Молибден Мышьяк Нитраты (в пересчете на N) ПАА | 0,5 0,05 | Стронций Фтор: для I и II климатических поясов для III климатического пояса | 1,5 1,2 |
| Свинец | 2 0,1 | пояса для IV | 0,7 |
Если в воде одновременно обнаруживается несколько веществ, нормируемых по органолептическому или санитарно-токсикологическому показателям, суммарная концентрация их, выраженная в долях от ПДК каждого вещества, не должна превышать единицы, т. е.
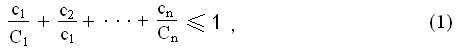 |
где с — обнаруженные концентрации веществ, мг/л; С — ПДК для тех же веществ, мг/л.
Безопасность воды в санитарно-эпидемиологическом отношении гарантируется при условии соблюдения требований ГОСТ 2874—73 по бактериологическим показателям. Общее количество бактерий в 1 мл неразбавленной питьевой воды не должно превышать 100. Число бактерий группы кишечной палочки не должно быть более трех в 1 л воды. В питьевой воде должны отсутствовать организмы, различаемые невооруженным глазом.
Лекция № 2
Дата добавления: 2020-02-05; просмотров: 648;











