Молекулярно-кинетические свойства коллоидных систем.
1. Броуновское движение препятствует оседанию коллоидных частиц. Причиной броуновского движения является невидимое движение молекул растворителя, сталкивающихся с коллоидными частицами.
2. Так как коллоидные частицы обладают тепловым движением, то для них характерно явление диффузии.
Формула Эйнштейна:
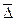 =
= 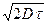 ,
,
где 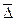 - среднее смещение частицы;
- среднее смещение частицы;
D – коэффициент диффузии;
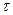 – отрезок времени, за которое произошло смещение частицы.
– отрезок времени, за которое произошло смещение частицы.
Коэффициент диффузии равен количеству вещества, проходящему за секунду через сечение 1 см2, когда разность концентрации на расстоянии 1 см равна единице:
D=RT/6πrŋNa ,
где R – газовая постоянная;
T – температура системы, К;
r – радиус частицы;
ŋ – вязкость среды;
Na - число Авогадро.
3. Осмотическое давление золя мало по сравнению с истинными растворами. Если взять для приготовления истинного и коллоидного раствора одно и то же количество вещества, то в коллоидном растворе частичек будет меньше, так как они крупнее.
Концентрация коллоидного раствора характеризуется числом частиц в единице объёма (частичная концентрация ν). Кроме этого есть грам-частичная концентрация:
Cd= 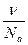
Малая грам-частичная концентрация коллоидного раствора ведёт к уменьшению осмотического давления.
p=cRT
p=CdKT
K=R/Na
4. В коллоидных системах наблюдается распределение коллоидных частиц по высоте. В нижних слоях их больше, в высоких - меньше. Такое распределение частиц называется перреновским седиментационным равновесием (аналогично распределению газа в атмосфере).
Скорость установившегося седиментационного равновесия мала, но оно может сохраняться сколь угодно долго.
ln C1/C2=mg (h2-h1)Na(P-Po)/RTP,
где С1 - концентрация на высоте h1;
C2 – концентрация на высоте h2;
m – масса частицы;
Na – число Авогадро;
P – средняя плотность частиц;
Ро – плотность дисперсионной среды.
Дата добавления: 2020-02-05; просмотров: 877;











