Классификация золей
Дисперсная система с размером частиц от 1 до 100 нм, распределённых в той или иной среде, называются коллоидным раствором или золем. Коллоидные системы являются гетерогенными системами, состоящими из двух или более фаз.
Характеристикой коллоидного раствора является величина свободной межфазной энергии. Величина эта зависит от:
- удельной поверхности частиц S0;
S0= 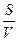 ,
,
где S - суммарная поверхность;
V - объём дисперсной фазы;
-степени дисперсности D;
D= 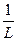 ,
,
где L – размер частиц.
Существует несколько классификаций коллоидных систем:
-классификация по агрегатному состоянию дисперсионной среды:
1. Аэрозоли - дисперсионная среда газообразная (дым, туман и т.д.).
2. Лиозоли – дисперсионная среда жидкость (гидрозоли).
3. Солиозоли – дисперсионная среда твёрдая (сплавы).
4. Пены – дисперсия газа в жидкости;
-классификация по межфазному взаимодействию:
1. Лиофильные – характеризуются сильным межмолекулярным взаимодействием между веществом дисперсной фазы со средой.
2. Лиофобные – слабое взаимодействие;
-классификация по внутренней структуре частиц:
1. Суспензоиды – высокодисперсные гетерогенные системы (лиофильные и лиофобные) неустойчивые и необратимые.
От суспензий они отличаются размерами частиц. Они не могут длительно существовать в отсутствии стабилизатора дисперсности (как и суспензии). Необратимые, т.к. осадки суспензоидов остающиеся при выпаривании таких коллоидов не образуют вновь золя при контакте с дисперсионной средой. К ним относятся золи металлов, их оксидов, гидроксидов, различных неорганических солей.
Свойства суспензоидов определяются очень сильной поверхностной энергией, это приводит к неустойчивости их без стабилизатора.
Высокомолекулярные соединения (белки, полипептиды, поливиниловый спирт и др.), добавляемые для стабилизации дисперсных систем называются защитными коллоидами.
Адсорбируясь на границе раздела фаз, они образуют в поверхностном слое структуры, создающие барьер, препятствующий объединению частиц дисперсной фазы.
2. Молекулярные коллоиды – гомогенные системы, устойчивые и обратимые. К ним относятся высокомолекулярные вещества с молекулярной массой от десяти тысяч до нескольких миллионов. Молекулы этих веществ имеют размеры коллоидных частиц, поэтому такие молекулы называются макромолекулами. Образование молекулярных коллоидных систем происходит в процессе набухания.
При неограниченном набухании полимер переходит в растворимое состояние с образованием гомогенной системы. Растворы молекулярных коллоидов легко превращаются в гетерогенные системы при незначительном изменении состава среды (белок, растворённый в воде, при добавлении спирта переходит в лиофобный золь).
3. Мицеллярные коллоиды (полуколлоиды). Коллоиднодисперсные частицы этого типа возникают при высокой концентрации дифильных молекул низкомолекулярных веществ путем их ассоциации в агрегаты молекул (мицеллы) сферической или пластинчатой формы.
Дифильные молекулы состоят из углеводородного радикала, имеющего сродство к неполярным растворителям, и гидрофильной группы, имеющей сродство к воде.
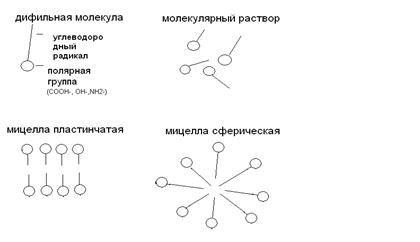
Рис. 9 . Образование мицелл из дифильных молекул
Мицеллы представляют собой скопление правильно расположенных молекул, удерживаемых дисперсионными силами. Образование мицелл характерно для водных растворов моющих веществ (мыла), некоторых органических красителей и т.д.
Дата добавления: 2020-02-05; просмотров: 1367;











