Химические методы очистки сточных вод
9.4.2.1. Тяжелые металлы.При очистке сточных вод от солей тяжелых металлов используют методы осаждения; такие ионы как Zn2+, Cu2+, Ni2+ из сточных вод можно удалить в виде труднорастворимых оснований, сульфидов, карбонатов:
Сu2+ + 2OH- = Cu(OH)2 pH 8-10
Ni2+ + 2OH- = Ni(OH)2 pH 9.5
Zn2+ + 2OH- = Zn(OH)2 pH 9-9.2
При действии соды образуются труднорастворимые основные карбонаты
2СuSO4 + 3Na2CO3 + 2H2O → (CuOH)2 CO3↓ + 2Na2SO4+ 2NaHCO3
в ионном виде.
2Сu2+ + CO 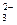 + 2OH- → (CuOH)2CO3↓
+ 2OH- → (CuOH)2CO3↓
2Ni2+ + CO 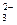 + 2OH- → (NiOH)2CO3↓
+ 2OH- → (NiOH)2CO3↓
3Zn2+ + 5CO 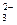 +4H2O → Zn3(OH)4CO3↓ + 4HCO
+4H2O → Zn3(OH)4CO3↓ + 4HCO 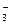
Наиболее полное осаждение ионов Zn2+ и Hg2+ достигается при обработке вод сульфидом натрия.
Hg(NO3)2 + Na2S → ↓HgS + 2NaNO3
ZnSO4 + Na2S → ↓ZnS + Na2SO4
HgS - образуется в тонкодисперсном состоянии, поэтому его коагулируют введением алюминиевого или железного коагулянта. После такой обработки содержание ртути не более 0,07 мг/л.
Недостаток: образование HgS при понижении рН.
Для удаления цианидов используют реакции окисления хлором, хлорной известью и другими реагентами. Реакция ведется в щелочной среде рН > 7.
NaCN + Cl2+ NaOH → NаCNO + NaCl + H2O
цианат Na
В воде цианаты гидролизуются с образованием нетоксичных соединений
2NaCNO + 4 H2O → 2(NH4)CO3 + Na2CO3
При очистке от соединений хрома на первой стадии его восстанавливают до Cr 3+. Для этого воду обрабатывают гидросульфитом натрия NaHSO3 или сульфатом железа II.
K2Cr2O7 + 6FeSO4 + 7H2SO4 → Cr2(SO4)3 + 3Fe2(SO4)3 + K2SO4 + 7H2O.
Образующийся сульфат хрома III обрабатывают NaOH, в результате чего образуется труднорастворимый гидроксид Cr III.
Cr2(SO4)3 + 6NaOH → 2Cr(OH)3 ↓ +3Na2SO4 (pH ≥9).
Окислительные методы используются и для доочистки сточных вод от органических загрязнений. В качестве окислителей применяется Cl2, O3, KMnO4. Особенно перспективно применение озона.
Иногда при очистке стоков применяется электрохимический метод, основанный на протекании окислительно – восстановительных реакций непосредственно у электродов. Например: удаление из воды цианидов (анодное окисление). Цианиды на аноде окисляются до цианатов:
CN- + 2OH- -ē → CNO- + H2O.
Цианаты окисляются с образованием нетоксичных соединений:
2CNO- + 4OH- +6ē → N2 + 2CO2 + 2H2O.
Химические методы являются деструктивными. Недостатки:
- использование реагентов;
- дозировка;
- соблюдение мер предосторожности;
- повышение солесодержания затрудняет повторное использование воды.
Но этот метод находит все более широкое применение (до 10,2%).
Кислые и щелочные стоки перед спуском в водоем подвергаются нейтрализации. Она осуществляется за счет щелочности воды водоема.
Н+ + НСО 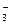 → Н2О + СО2.
→ Н2О + СО2.
Избыток гидроксид ионов, поступающих со щелочным стоком, связывается гидрокарбонатами кальция в труднорастворимый карбонат:
Ca(HCO3)2 + 2NaOH → CaCO3 + 2H2O + Na2CO3
При значительном содержании свободных кислот или оснований в сточных водах производится их полная или частичная нейтрализация. Пи этом учитывается только свободная кислотность или щелочность. При наличии на предприятии кислых и щелочных стоков может проводиться их взаимная нейтрализация. Нейтрализация проводится:
- реагентным методом (Са(ОН)2 );
- фильтрационным методом.
Дата добавления: 2020-02-05; просмотров: 857;











