Обеззараживание хлором и хлорсодержащими веществами
Из всех соединений хлора наиболее эффективным реагентом является хлорноватистая кислота. Она вступает в реакцию с ферментами бактерий и нарушает обмен веществ в бактериальной клетке. Хлор, при растворении в воде образует две кислоты: соляную и хлорноватистую.
Cl2 + H2O → HCl + HOCl
HOCl - очень слабая кислота и ее диссоциация зависит от рН среды. Чем ниже рН, тем выше содержание в воде хлорноватистой кислоты, которая обеспечивает процесс хлорирования воды.
При введении в воду хлорсодержащих веществ происходит гидролиз с образованием HOCl.
Ca(ClO)2 + H2O ↔CaCl2 +Ca(OH)2 +HOCl
хлорная известь
NaOCl + H2CO3 ↔ HOCl + NaHCO3
гипохлорт Na
NaOCl + H2O ↔ NaOH + HOCl
CaOCl + H2O ↔ Ca(OH)2 + HOCl
гипохлорит Са
На практике обеззараживания воды интерес представляет двуокись хлора, ее получают действием HCl +хлорит натрия
NaCl2O + HCl ↔ NaCl + ClO2 +H2O
При выборе дезинфицирующего вещества следует учитывать содержание в нем «активного» хлора.
Активным называется количество молекулярного хлора, отвечающее окислительной способности данного соединения относительно иодистого калия в кислой среде.
Понятие «активный» хлор определяет не истинное содержание хлора, а окислительную способность соединения в кислой среде по КI.
Например, в моле NaCl содержится 35,5г Сl, а содержание активного хлора равно нулю.
В моле NaOCl – истинное содержание хлора – 35,5, а активного хлора 71г.
Содержание активного хлора в хлорсодержащихся веществах в процентах можно подсчитать по формуле.
Cl (%) = (nM/ Mo) ·100.
Где n - число гипохлоритных ионов в молекуле хлорсодержащего вещества.
Mo – молекулярная масса хлорсодержащегося вещества.
М – молекулярная масса хлора (71 г/моль).
Например: определим содержание активного хлора в хлорной извести следующего состава.
3CaOCl2 · Ca(OH)2 ·5H2O
[Cl2] = (3·71·100) : 545 = 39.08%
При определении дозы хлора следует исходить из хлорпоглощаемости воды и некоторого избытка хлора, обеспечивающего бактерицидный эффект.
Зависимость поглощения хлора водой от его концентрации находят экспериментально.
Для этого к воде добавляют различные дозы хлора и определяют его концентрацию по истечении некоторого времени. На основании опытных данных строят кривую хлороемкости.
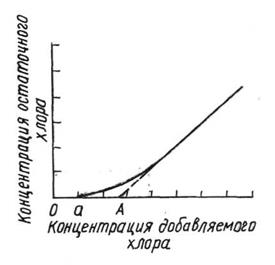
|
Рис. 5. Общий вид кривой хлороемкости.
При малых дозах концентрации остаточный Cl =0. С увеличением ее начинает появляться остаточный хлор. Причем с некоторой величины он становится прямо пропорциональным концентрации вводимого хлора, за вычетом истиной «а».
Переход кривой в прямую показывает, что все процессы окисления, которые могут протекать под действием хлора, закончены. Продолжение этой прямой до пересечения с осью абсцисс дает отрезок ОА, соответствующий полной хлороемкости или хлорпоглощаемости воды.
8.2.2. Хлорирование с аммонизацией применяют для избежания образования хлорфенольных запахов.
В воду вводятся аммиак или соли аммония.
NH3 + Cl ↔NH2Cl+HCl
хлорамин
Гидролиз:
NH2Cl+2H2O ↔ NH4OH +HOCl
Медленный гидролиз хлорамина приводит к постепенному поступлению НОСl в оду, что обеспечивает более эффективное бактерицидное действие.
В водах, содержащих аммиак или аммонийные соли, кривая хлороемкости имеет вид:

Рис. 6 . Хлороемкость воды в присутствии иона аммония.
Процесс гидролиза хлораминов (NH2Cl) протекает медленнее, чем свободного хлора, поэтому вначале остаточный хлор увеличивается, достигая максимума, а затем из за протекания химических реакций уменьшается – минимум на кривой.
Обработка воды хлором дозами меньшими, чем те, которые соответствуют образованию минимума, называются хлорированием до точки перелома, большими дозами – хлорирование за точкой перелома.
Обычно питьевая вода хлорируется малыми дозами, а сточная – большими. Если хлорирование производится после всех других процессов обработки воды и является завершающим этапом очистки, то его называют постхлорированием.
Прехлорирование – хлорирование повышенными дозами. Доза остаточного хлора при прехлорировании устанавливается в пределах 1-10 мг/л.
Обеззараживание воды йодом производится в плавательных бассейнах, при рН< 7 доза йода для обеззараживания воды природных водоисточников 0,3 -1 мг/л.
Озонирование воды
Озон – аллотропическое видоизменение кислорода (О3). Он образуется из кислорода по уравнению
3О2 ↔ 2О3 -69ккал.
Растворимость озона в природных водах зависит от реакции среды и от количества веществ, растворенных в воде.
Бактерицидное действие озона связано с его высоким окислительным потенциалом и легкостью его диффузии через клеточные оболочки микроорганизмов.
Он окисляет органические вещества микробной клетки и приводит ее к гибели. Озон действует на бактерии быстрее, чем хлор и его расход меньше.
Например: вирус полимиелита погибает под действием 0,45 мг/л озона через 2 мин., а хлора через 3 часа, при дозе 2 мг/л.
Озонирование имеет ряд преимуществ:
1) улучшение органолептических свойств воды,
2) не требует дополнительных мероприятий для удаления избытка реагента,
3) легкость получения.
Недостатки:
1) затраты электроэнергии,
2) коррозионная активность, озон и его растворы разрушают сталь, чугун, медь, резину, эбонит.
Кроме этого применяются для обеззараживания:
1. ионы серебра (олигодинамия).
2. Ультрафиолетовые лучи.
3. Ультразвуковые волны.
Дата добавления: 2020-02-05; просмотров: 1009;











