Удаление из воды соединений железа
В природных водах встречаются соединения железа со степенью окисления Fe2+ и Fe3+. Железо может присутствовать в растворенном, коллоидном и взвешенном состояниях.
Источники: растворение железосодержащих пород под действием кислот (угольной, серной, органических) и окислителей (кислород).
Например: минерал пирит FeS2 может давать сульфат и гидрокарбонат железа.
FeS2 + СО2 + 2Н2О → Fe(HCO3)2 + H2S + S
2 FeS2 +7O2 + 2Н2О → 2FeSO4 +2H2SO4
Соединение Fe2+ встречаются в основном в подземных водах. Содержание их колеблется от 1мг/л до нескольких десятков.
Формы: Fe(HCO3)2 и 2FeSO4.
При выходе подземных вод на поверхность происходит окисление Fe2+ и Fe3+ и гидролиз с образованием гидроксида железа III.
4Fe(HCO3)2 + O2 + 2H2O → 4Fe(OH)3↓ + 8CO2
4FeSO4 + O2 + 10H2O → 4Fe(OH)3↓+ 4 H2SO4
Это объясняет образование бурого осадка при стоянии прозрачной артезианской воды.
Окисление железа II может происходить с помощью железобактерий. В поверхностных водах содержаться неорганические формы железа III и органические – гуматы железа.
Содержание железа III обычно составляет сотые или десятые доли мг/л, так как растворимость Fe3+ очень мала (зависит от рН). Гуматы железа имеют бурую окраску и обуславливают цветность природных вод. Если концентрация железа свыше 0,3 мг/л, то вода приобретает железистый привкус. Отдельные отрасли предъявляют более жесткие требования к содержанию железа: производство вискозного волокна – 0,03мг/л, кинопленки -0,05мг/л.
Процесс обработки воды, проводимый для снижения содержания железа, называется обезжелезиванием. Наиболее простой метод обезжелезивания- аэрация. Он заключается в насыщении воды кислородом для окисления железа II в железо III. На окисление 1 мг железа расходуется 0,143 мг кислорода. При этом идут окисление и гидролиз.
Fe(HCO3)2 + H2O → Fe(OH)2 + CO2 + H2O
Fe(ОН)2 + О2 + H2O → Fe(OH)3 ↓
Метод упрощенной аэрации для удаления неорганического железа II при концентрации его 10 мг/л применяется для вод с окисляемостью до 6-7 мг/л, рН > 7 и другими показателями (аммонийный азот до 1 мг/л, сероводорода 0,2 мг/л и т.д.).
Если качество воды не соответствует, то проводится глубокая аэрация воды или она сопровождается хлорированием или известкованием. При рН< 7 и значительном содержании СО2 проводится известкование.
Ca(OH)2 + CO2 → CaCO3 ↓ + H2O
Fe(HCO3)2 + Ca(OH)2 → Fe(OH)2 + CaCO3 ↓+ H2O
Fe(HCO3)2 + Cl2 + Ca(HCO3)2 → Fe(OH)3 ↓+ CaCl2 + CO2
Гидроксид кальция взаимодействует с СО2.
СО2 + Са(ОН)2 → СаСО3 ↓+ Н2О
Fe(HCO3)2 + Ca(OH)2 → Fe(OH)2 + CaCO3 ↓+H2O
Сульфат железа II удаляется аэрацией воды с подщелачиванием.
FeSO4 + Ca(OH)2 → Fe(OH)2 + CaSO4
Fe(OH)2 + O2 + H2O → Fe(OH)3 ↓
При хлорировании воды с достаточным щелочным резервом протекают процессы, которые выражаются суммарным уравнением.
2Fe(HCO3)2 + Cl2 + 2Ca(HCO3)2 → 2Fe(OH)3 + CaCl2 + CO2
Могут применяться перманганат калия КMnO4 и диоксид марганца MnO2.
Для удаления неорганического железа может применятся метод ионного обмена на Н - катионовых фильтрах.
R
2R – H + Fe2+ → > Fe + 2H+
R
Органические формы железа могут удаляться действием окислителей: Cl2, O3, KMnO4.
Для вод со значительным содержанием железа эффективным методом обезжелезивания являются электрокоагуляция с использованием алюминиевого или стального электродов. Применение этого метода позволяет одновременно проводить осветление, обесцвечивание и обескремнивание воды, способствует снижению окисляемости.
9.4.2.3. Удаление из воды соединений марганца
Марганец в природных водах обычно сопутствует железу, но в меньшей концентрации до 0,05 мг/л. ПДК для питьевой воды – 0,1 мг/л. Формы: гидрокарбонат и сульфат Mn2+, органические соединения.
Окисление марганца происходит при рН > 9,5. Марганец удаляется из воды одновременно с железом II при известковании и аэрации.
MnSO4 + Ca(OH)2 = Mn(OH)2 + CaSO4
2Mn(OH)2 + O2 + 2H2O → 2Mn(OH)4
Выпадает осадок диоксида марганца. Можно использовать окислители: перманганат калия, хлор, озон, диоксид хлора.
MnSO4 + 2KMnO + H2O → 2MnO2 ↓+ K2SO4 + H2SO4
MnSO4 + Cl2 + H2O → MnO2 ↓ + HCl + H2SO4
MnSO4 + O3 + H2O → MnO2 ↓ + O2 + H2SO4
MnSO4 + ClO2 + H2O → MnO2 ↓+ HCl + H2SO4
Можно применять ионообменный способ. Коллоидные соединения марганца удаляются коагуляцией. В ГДР применяется биохимический метод с использованием марганецокисляющих бактерий.
9.4.2.4. Фторирование и дефторирование воды
Содержание фтора в природных водах колеблется в широких пределах от сотых долей мг/л до нескольких десятков. В большинстве вод до 0,5-0,7мг/л. В подземных водах выше 1 мг/л. В южных засушливых районах содержание фтора выше, чем в средней полосе и на севере. Так, в Казахстане до 10мг/л. Основная форма: фторид – ион (F-). При его недостатке – кариес, при избытке – флюороз (пятнистая эмаль). При недостатке фтора проводят фторирование воды.
Реагенты: растворимые соединения фтора: фторид натрия (NaF), кремнефторид натрия (Na2SiF6), гексафторкремниевая кислота (H2 SiF6).
Так как в процессе обработки воды содержание фтора несколько снижается, то фторирование проводят после коагуляции, перед обеззараживанием воды. Содержание фтора в воде устанавливается в зависимости от климатических условий, так как поступление фтора в организм зависит от водопотребления.
При концентрации фтора выше ПДК проводится дефторирование (обесфторивание). Растворимость даже труднорастворимых соединений фтора выше, чем ПДК фтора в воде. Это затрудняет обработку.
Методы фторирования основаны на том, что некоторые труднорастворимые соединения (оксиды и гидроксиды алюминия, магния, фосфаты кальция, основные соли алюминия) избирательно сорбируют из воды ионы фтора по методу ионного обмена.
В этом случае фториды извлекаются сорбцией их свежеобразованными хлопьями вышеуказанных сорбентов, или фильтрованием воды через слой сорбента. Для подземных вод, не требующих дополнительной обработки, совместно с коагуляцией. Одним из сорбентов является гидроксид магния II.
Mg(OH)2 + F- → Mg- OH-F + OH-.
Снижение концентрации фтора при коагуляции объясняется способностью гидроксида алюминия или гидроксосульфата (AlOHSO4) сорбировать ионы F-. Дефторирование воды, не требующей дополнительной очистки осуществляется фильтрационными методами. В качестве загрузки применяются: обожженный доломит MgO, активированный оксид Al, гидроксилаппатит. Наиболее распространенным является активированный оксид Al. Активация его проводится по методике, разработанной ВодГео. В этом случае Al2O3 прокаливается в течение 3 часов, при температуре 8000С затем обработка Na2CO3 (сода) и снова 30мин. при 8000С. В результате образуется активированный Al2O3 , обладающий свойствами анионита.
Регенерация сорбента осуществляется 2% раствором NaOH или Al2(SO4)3. В случае NaOH процесс дефторирования идет по схеме
R – OH + F- ↔ R – F + OH-
В случае Al2(SO4)3
R2 – SO4 + 2F- ↔ 2RF + SO 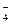
Обменная емкость сорбента по F- уменьшается с уменьшением рН. Необходимо проводить пробное дефторирование при выборе метода.
9.4.2.5. Обескремнивание воды
Содержание кремния ограничивается в теплоэнергетике, при производстве кордной целлюлозы и искусственных волокон. Свободная кремниевая кислота присутствует в виде коллоидного раствора метакремниевой кислоты H2SiO3 или (SiO2 ∙ H2O). Содержание различных форм кремниевой кислоты (свободной, гидросиликат - H2SiO3 и силикат SiO 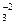 ионов) зависит от рН.
ионов) зависит от рН.
Удаление производится: 1) коагуляцией солями железа.
2) При известковании воды: Na2SiO3 + Ca(OH)2 → 2NaOH + CaSiO3↓.
3) Магнезиальные методы основаны на сорбции различных форм кремниевой кислоты оксидом магния и другими его соединениями.
В качестве реагентов применяется оксид магния (каустический магнезит) или доломитированная известь (CaO ∙ MgO).
Недостатки: необходимость подогрева, громоздкость аппаратуры.
4) Применение высокоосновного анионита АВ -17. Глубина обескремнивания может достигать 0,01 -0,05мг/л.
9.4.2.6. Удаление из воды растворенных газов
Этот процесс называется дегазацией.
Нежелательными являются: сероводород, кислород, диоксид углерода. Существуют химические и физические методы дегазации.
Химические методы заключаются в связывании растворенных в воде газов в другие химические соединения.
1. Сероводород удаляется хлором:
H2S + Cl2 = 2HCl + S
H2S + 4Cl2 + 4H2O = H2SO4 + 8HCl.
Метод аэрации может дополняться биохимическим окислением сероводорода серобактериями.
2. Кислород можно удалять с помощью восстановителей: SO2, Na2SO3 или металлическое железо
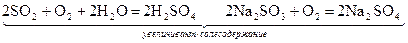
увеличивают солесодержание
NH2 – NH2 + O2 = N2 + 2H2O - лучше, но дорого.
гидразин
3.
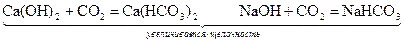
Чаще применяются физические методы, так как не требуют реактивов, не увеличивают солесодержание, улучшаются условия работы персонала.
Дата добавления: 2020-02-05; просмотров: 890;











