Универсальная газовая постоянная
Умножив обе части уравнения (1) на молекулярную массу µ, получим уравнение состояния для одного моля идеального газа
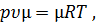
| (11) |
учитывая, что
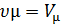
|
окончательно имеет
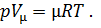
| (12) |
Обозначим произведение µR из уравнения (12) через Ro ;решим его относительно µR = Ro
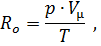
| (13) |
где 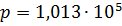 н/м2 – давление при нормальных условиях;
н/м2 – давление при нормальных условиях;
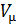 = 22,4 м3/моль – объем моля;
= 22,4 м3/моль – объем моля;
T=273oK – температура при нормальных условиях.
Подставив в уравнение (13) соответствующие числовые значения
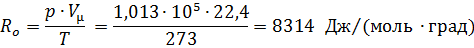
|
или
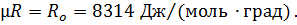
|
Величина Ro называется универсальная газовая постоянная или газовая постоянная одного моля любого газа. Газовую постоянную R, входящую в уравнение состояния (1) можно определить ,разделив универсальную газовую постоянную на молекулярную массу.
Например, для описи углерода CO с молекулярной массой µ=12+16=28 газовая постоянная будет равна
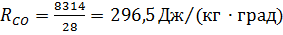
|
Теплоемкость
Чтобы два разных вещества с одинаковой массой нагреть до одинаковой температуры , необходимо затратить различное количество теплоты.
Например, на нагревание воды необходимо затратить тепла примерно в девять раз больше , чем на нагревание до той же температуры такой же массы железа. Таким образом, каждое вещество обладает своей теплоемкостью.
Теплоемкостью тела называют количество теплоты ,необходимое для изменения температуры тела на один градус.
Средней в интервале температур T1 – T2 теплоемкостью тела Сm называют количество теплоты q, необходимое для повышения температуры тела на 1o
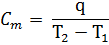
| (14) |
При уменьшении разности температур Т2 – Т1 средняя теплоемкость приближается к истинной.
Если к телу подведено бесконечно малое количество теплоты dq и температура тела Т повысилась на величину dT, то отношение
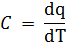
| (15) |
называется истинной теплоемкостью тела при температуре Т.
Дата добавления: 2016-06-15; просмотров: 2845;











