Глава 5. Электрохимические методы анализа
Электрохимические методы анализа основаны на изучении и практическом использовании процессов и явлений, протекающих на электродах или в приэлектродном пространстве. Аналитическим сигналом, функционально связанным с природой и концентрацией определяемого компонента, является любой электрический параметр (потенциал, сила тока, сопротивление и т.д.), который можно надежно измерить.
В настоящее время электрохимические методы анализа занимают одно из ведущих мест среди методов контроля пищевых технологических процессов, так как обладают уникальным сочетанием всех необходимых качеств. Они универсальны и способны обеспечить определение большого количества как неорганических, так и органическихвеществ. Для них характерны высокая чувствительность и селективность, быстротаотклика на изменение состава анализируемого объекта, легкость автоматизации и возможность дистанционногоуправления. И, наконец, они не требуют дорогостоящего аналитического оборудования и могут быть применены в лабораторных и производственных условиях.
Классификация электрохимических методов.По природе измеряемого параметра электрохимические методы анализа подразделяют на несколько групп (табл.).
Таблица. Классификация электрохимических методов по измеряемому параметру.
| Измеряемый параметр | Условия измерения | Метод |
| Потенциал Е. В Ток I, мА, мкА Количество электричества Q, Кл Удельная электрическая проводимость c, См×см-1 Масса m, г | I = 0 I = f(Eналож) I=const или E=const I~ (1000 Гц) I=const или E=const | Потенциометрия Вольтамперометрия Кулонометрия Кондуктометрия Электрогравиметрия |
Для выполнения электрохимических измерений необходима электрохимическая цепь, включающая электрохимическую ячейку (в простейшем случае состоящую из двух электродов, погруженных в анализируемый раствор) и внешнюю цепь (металлические проводники и измерительное устройство).
Электрохимическая ячейка.В электрохимических методах реализуется способность окислительно-восстановительных реакций протекать не только при непосредственном контакте окислителя и восстановителя, но и при их пространственном разделении. Например, реакция Red1 + Ox2 = Ox1 + Red2 может быть проведена в электрохимической ячейке (рис. 1), которая в простейшем случае включает два электрода (Э1 и Э2), погруженных в раствор электролита. Механизм переноса электричества различен на разных участках электрической цепи: в электродах и металлических проводниках электричество переносят электроны (электронная проводимость), в растворе электричество переносят ионы (ионная проводимость), а на поверхности электродов ионная проводимость переходит в электронную. Это сопровождается электрохимическими превращениями и протеканием фарадеевских токов: анодного тока окисления Red1 ® Ox1 с отщеплением электронов (электрод Э1, анод) или катодного тока восстановления Ox2 ® Red2 с присоединением электронов (электрод Э2, катод). Условно считают катодный ток положительным, а анодный ток – отрицательным.
|
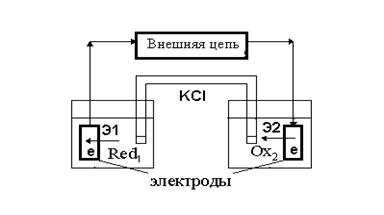
Один из электродов электрохимической ячейки должен обратимо реагировать на изменение состава анализируемого раствора и, соответственно, на изменение концентрации определяемого вещества; такой электрод называют индикаторным. Индикаторные электроды не должны оказывать влияния на состав анализируемого раствора, не должны взаимодействовать с компонентами раствора, поэтому их изготавливают из химически инертных проводящих материалов: благородных металлов (платины, золота, ртути), углеродных материалов (графита, стеклоуглерода).
Электрод, по отношению к которому измеряют потенциал индикаторного электрода, называют электродом сравнения. Этот электрод должен иметь постоянный, хорошо воспроизводимый и независимый от состава раствора потенциал, служащий надежной точкой отсчета. Универсальным электродом сравнения является стандартный водородный электрод, но для практической работы он неудобен, поэтому в качестве электродов сравнения обычно используют хлоридсеребряный и каломельный электроды.
Дата добавления: 2022-02-05; просмотров: 537;











