Кондуктометрический метод анализа
Кондуктометрия основана на измерении удельной электропроводности анализируемого раствора. Электропроводностью называют величину, обратную электрическому сопротивлению R. Единицей измерения электропроводности является Ом-1 или сименс (См). Растворы электролитов, являясь проводниками II рода, подчиняются закону Ома. Сопротивление раствора прямо пропорционально расстоянию между электродами d и обратно пропорционально площади их поверхности А:
R = r 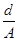 ,
,
где r – удельное сопротивление (Ом · см).
При d=1 см и А=1 см2 имеем R = r, следовательно, удельное сопротивление равно сопротивлению 1 см3 раствора.
Величину, обратную удельному сопротивлению, называют удельной электропроводностью c = 1/r. Удельная электропроводность численно равна току (в A), проходящему через слой раствора с поперечным сечением, равным единице, под действием градиента потенциала 1 В на единицу длины.
Электропроводность разбавленных растворов электролитов зависит от концентрации ионов в растворе, заряда иона, скорости движения ионов в электрическом поле, то есть их эквивалентной ионной электропроводности (подвижности). Она равна произведению абсолютной скорости движения иона на константу Фарадея и имеет размерность См·см2 (моль·экв). Под эквивалентом в этом случае подразумевают частицу с единичным зарядом, например К+, С1~, 1/2 Mg2+, 1/3 А13+.
Эквивалентная электропроводность (подвижность) уменьшается с увеличением концентрации раствора. При повышении концентрации электролита возрастает ионная сила, и скорость движения ионов понижается за счет межионных взаимодействий. При бесконечном разбавлении подвижности ионов становятся постоянными и максимальными, и эквивалентная электропроводность раствора электролита l0 равна сумме подвижностей ионов, отнесенных к единичному заряду:
l° = l0+ + l0-
|
|
|
| |
Различают прямую и косвенную кондуктометрию, или кондуктометрическое титрование.
Прямая кондуктометрия. В простейших случаях измеренная величина электропроводности раствора может указать на наличие в его составе электролитов и, соответственно, позволяет сделать заключение, например, о том, что общая концентрация токсичных компонентов в анализируемом растворе не превышает ПДК. Построив график зависимости электропроводности от концентрации вещества и определив электропроводность раствора этого вещества неизвестной концентрации, можно по графику найти его концентрацию.
Однако прямую кондуктометриюмало применяют в химическом анализе. Причина этого в том, что электропроводность является величиной аддитивной и определяется присутствием всех ионов в растворе. Прямые кондуктометрические измерения используют для анализа газов, контроля качества воды, применяемой в химической лаборатории. Современные установки для перегонки или деминерализации воды снабжают кондуктометрическими датчиками - кондуктометрами - для измерения удельной электропроводности растворов. Детекторы по электропроводности применяют в ионной хроматографии.
Кондуктометрическое титрование. Для кондуктометрического титрования пригодны кислотно-основные или осадительные реакции, сопровождающиеся заметным изменением электропроводности вследствие образования малодиссоциирующих или малорастворимых соединений.
Достоинством метода кондуктометрического титрования является возможность высокоточных измерений даже в очень разбавленных растворах. В термостатируемой ячейке относительная погрешность определения 1·10-4 М растворов не превышает 2%. В отличие от титриметрии с визуальными индикаторами кондуктометрическое титрование пригодно для анализа окрашенных или мутных растворов. Графический способ нахождения конечной точки титрования позволяет избежать трудностей, возникающих из-за замедления реакции вблизи конца титрования и снижающих точность фиксирования конечной точки. Иногда с помощью кондуктометрического титрования можно последовательно определять компоненты смеси, например можно титровать сильные и слабые кислоты.
Вопросы
1. Виды погрешностей.
2. Как рассчитать дисперсию отдельного определения малой выборки?
4. Какие ионы имеют аномально высокую подвижность в водном растворе?
5. Математическое выражение закона движения ионов Кольрауша.
6. Как рассчитать ЭДС гальванического элемента?
7. Для чего используют элемент Вестона в компенсационной схеме измерения ЭДС ГЭ.
8. Чем потенциометрическое титрование отличается от обычного титрования?
9. При каких условиях стеклянный электрод может быть использован в качестве индикаторного для измерения рН?
10. Что характеризует коэффициент селективности ионоселективного электрода?
Дата добавления: 2022-02-05; просмотров: 969;











