Характеристика реакций
Чувствительность реакции характеризуется взаимосвязанными показателями:
- открываемый минимум (m) – наименьшая масса вещества (в мкг), которая может быть обнаружена посредством данной реакции. Аналитическим целям удовлетворяют реакции, для которых m < 50 мкг;
- минимальная (предельная) концентрация (1:q) – характеризует минимальную концентрацию Cmin, при которой обнаружение вещества возможно в небольшом (одной капле) объеме раствора; q – объем раствора (мл), в котором содержится 1 грамм вещества;
- предельное разбавление (q) − величина, обратная концентрации; аналитическим целям удовлетворяют реакции, эффективные при разбавлении более 1000.
Если минимальный объем, требуемый для обнаружения ионов Vmin (мл), то
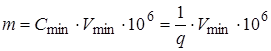 .
.
Аналитическая реакция тем чувствительнее, чем меньше открываемый минимум и предельная концентрация и чем больше предельное разбавление.
Специфичность. Специфической реакцией на данный ион называется такая реакция, которая позволяет обнаружить его в условиях опыта в смеси с другими ионами. Например, реакция со щелочью является специфической для обнаружения NH4+ в виде NH3 по запаху.
Ионные уравнения
При анализе неорганических веществ в большинстве случаев имеют дело с водными растворами кислот, оснований, солей, являющихся электролитами. Поэтому «мокрыми» реакциями открывают ионы, а не элементы или вещества.
Все реакции в (водных) растворах электролитов являются реакциями между ионами. Они называются ионными реакциями, а уравнения этих реакций − ионными уравнениями.
В этих уравнениях в молекулярной форме записываются вещества, которые:
- мало ионизируют (НОН),
- малорастворимы (выпадают в осадок, BaSO4↓),
- являются газами (CO2↑),
- являются простыми веществами (О2).
Например:
1. NaOH + HCl → NaCl + HOH – уравнение в молекулярной форме;
Na+ + OH‾ + H+ + Cl‾ → Na+ + Cl‾ + HOH – уравнение в ионной форме, полное ионное уравнение;
OH ‾ + H+ → HOH – сокращенное ионное уравнение.
2. BaCl2 + K2SO4 → 2KCl + BaSO4↓;
Ba2+ + 2Cl‾ + 2K+ + SO42‾ → 2K+ + 2Cl‾ + BaSO4↓;
Ba2+ + SO42‾ → BaSO4↓ – сокращенное ионное уравнение.
Для обнаружения Cl‾ используют раствор AgNO3:
HCl + AgNO3 → AgCl↓ + HNO3
− образуется белый творожистый осадок. Данной реакцией открывают не элемент хлор вообще, а именно хлорид ион Cl‾. Она неэффективна, если хлор присутствует в ином виде, например, NaClO3 или CHCl3. Также можно отметить, что реагентом является не AgNO3, а именно Ag+, а суть реакции выражается сокращенным ионным уравнением:
Ag+ + Cl− → AgCl.
Глава1.Качественный дробный и систематический анализы
Применяя специфические реакции можно обнаружить соответствующие ионы так называемым дробным методом, то есть непосредственно в отдельных порциях («раздробленного») исследуемого раствора, не учитывая возможное присутствие других ионов. При этом не имеет значения и порядок открытия ионов.
Если нет специфических реакций, то используют определенную последовательность реакций обнаружения отдельных ионов, представляющую систематический ход анализа. Он состоит в том, что к обнаружению каждого данного иона приступают лишь после того, как все другие ионы, мешающие его обнаружению, будут предварительно обнаружены и удалены из раствора.
Например, анализируемая смесь предположительно содержит Ca2+ и Ba2+, а нужно определить, есть ли Ca2+. Оба катиона образуют белые осадки с оксалат анионом (наиболее чувствительная реакция на кальций). Поэтому сначала выясняют, есть ли в растворе Ba2+, действуя хроматом калия, зная, что хромат кальция растворим:
Ba2+ + CrO42− → BaCrO4↓.
Если в отдельной порции раствора присутствие Ba2+ не подтвердилось, то открывают в другой порции Ca2+. Если Ba2+ присутствует, то его отделяют осаждением в виде желтого BaCrO4 центрифугированием или фильтрованием, проверяя полноту осаждения добавлением к фильтрату капли реагента. Затем в фильтрате открывают Сa2+ добавлением (NH4)2C2O4. Образование белого осадка доказывает присутствие Ca2+.
Кроме осаждения для отделения используют выпаривание и экстракцию органическими растворителями.
При систематическом ходе анализа ионы выделяют из сложной смеси не по одиночке, а целыми группами, пользуясь одинаковым отношением их к действию некоторых реагентов, называемых групповыми реагентами. Выделяемые группы ионов называют аналитическими группами. Групповой реагент должен удовлетворять следующим требованиям:
- практически полное осаждение (10-6 М);
- осадок должен легко растворяться в кислотах;
- избыток реагента не должен мешать открытию оставшихся ионов.
Существуют различные системы анализа: сульфидная, кислотно-щелочная, фосфатная и т.д.
Систематический ход анализа смеси катионов I÷VI групп
Анализ смеси катионов I÷VI групп начинают с открытия дробным методом катионов: NH4+, Na+, Fe2+, Fe3+, Сr3+, Sn2+, Mn2+, Bi3+, Sb3+, Co2+, Ni2+, Cu2+:
NH4+ - нагреванием со щелочами,
Na+ - методом фотометрии пламени,
Fe2+ - в солянокислой среде реакцией с К3[Fe (CN)6],
Fe3+ - в солянокислой среде реакцией с К4[Fe (CN)6],
Cr3+ - реакцией окисления в кислой среде до Cr2O72− и пероксида хрома СrO5 + амиловый спирт,
Sn2+ - реакцией с фосфоромолибдатом аммония (NH4)3[PMo12 O40],
Mn2+ - реакцией окисления висмутатом в кислой среде до МnO4−,
Bi3+ и Sb3+ - гидролизом,
Со2+ - реакцией с роданидом аммония NH4SCN + амиловый спирт,
Ni2+ - реакцией с диметилглиоксимом в присутствии NH3+амиловый спирт,
Сu2+ - реакцией с К4[Fe (CN)6],
- реакцией с избытком концентрированного аммиака.
Таблица 1
Дата добавления: 2022-02-05; просмотров: 399;











