Основные газовые законы и уравнение состояния
Закон Бойля-Мариотта (1662). Роберт Бойль нашел, что при Т=const объем данного количества газа пропорционален давлению, под которым он находится. Рассмотрим переход газа массой m из состояния 1 (Р1V1Т) в состояние 2 (Р2V2Т) при постоянной температуре Т (изотермический процесс). По закону Бойля Р1V1 = Р2V2 = Р3V3 …, т.е. РV = const.
Графически этот закон можно представить в координатах «РV – Р» прямой, параллельной оси давлений, а в координатах Р и V – ветвью гиперболы. Этот закон дает простой метод прогнозирования объема газов при изменении давления, оказываемого на них, с хорошим приближением для большинства газов кроме случаев, когда Т низкая и Р высокое.
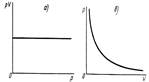
Рисунок 1. Графическое изображение закона Бойля-Мариотта
Пример. 1 моль газа занимает объем 24 дм3 при комнатной температуре и давлении 1 атм. Каким станет этот объем, если увеличить давление до 15 атм?
Решение. P1V1 = P2V2; (1 атм) ∙ (24 дм3) = (15 атм) ∙ (Х дм3); Х = 1,6 дм3.
Закон Шарля.Рассмотрим переход газа массой m из состояния 1 (Т1V1Р) в состояние 2 (Т2V2Р) при постоянном давлении (изобарный процесс).
Экспериментальным путем Шарль установил, что при этом объем газа линейно изменяется с температурой. Коэффициент пропорциональности равен 1/273,16. Это значит, что при каждом повышении температуры на 1 градус объем газа возрастает на 1/273,16 его первоначального значения. Было также показано, что V2/T2 = V1/T1 = const, т.е. отношение объема к абсолютной температуре при постоянном давлении постоянно:
V/ T = const:
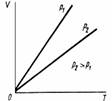
Рисунок 2. Графическое изображение закона Шарля
Закон Гей-Люссака. Рассмотрим переход газа массой m из состояния 1 (Т1VР1) в состояние 2 (Т2VР2) при постоянном объеме (изохорныйпроцесс).
При этом давление газа линейно изменяется с температурой с тем же коэффициентом пропорциональности. Т.о, при повышении Т на один градус давление газа увеличивается на 1/273,16 первоначального значения. Было также показано, что p2/T2 = p1/T1 = const, т.е. отношение давления к абсолютной температуре при постоянном объеме постоянно:
P/T = const.
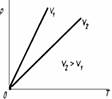
Рисунок 3. Графическое изображение закона Гей-Люссака
Закон Дальтона. Если в ограниченном пространстве объема V смешать несколько идеальных газов, то каждый газ будет оказывать свое собственное давление, называемое парциальным (т.е. такое, как если бы газ в одиночку занимал весь объем). Общее наблюдаемое давление будет равно сумме парциальных давлений каждого газа.
Этот закон выводится из уравнения состояния идеального газа. Допустим, что в ограниченном объеме V при температуре Т содержится смесь идеальных газов А, В, С, количество вещества (молей) которых равно соответственно nA, nB, nC. Общее измеренное давление составляет робщ. Тогда давление смеси газов определяется суммой молей nA+ nB + nC при температуре Т, объеме V и давлении робщ.
Используя уравнение состояния, получим:
робщ= (nA+ nB + nC)RT
Если nA молекул А занимают весь объем V при температуре Т, газ А оказывает давление рА, которое является парциальным давлением газа А в смеси.
Запишем уравнение состояния газа А:
рАV = nA RT.
Таким же образом для газов В и С имеем:
рВV = nВRT, рСV = nСRT.
Суммирование этих трех уравнений дает соотношение:
(рА +рВ +рС) = (nA+ nB + nC)∙RT
При сравнении (1) и (2) получим:
робщ= рА +рВ +рС =Σ парциальных давлений = nобщ.
Из приведенных уравнений можно легко получить значение молярной доли, показывающей, какую часть от общего количества (молей) смеси составляет данный газ. Например, для газа А парциальное давление равно рА = nA RT/V, а для суммы газов робщ = nобщ RT/V.
Поделив одно равенство на другое, получим:
рА /Pобщ = nA / nобщ = ХА,
где ХА – молярная доля газа А; ХВ и ХС – соответственно молярные доли газов В и С.
Естественно, сумма молярных долей всех газов, входящих в данную смесь, равна единице, т.е. для рассматриваемого случая ХА + ХВ +ХС =1.
Дата добавления: 2019-12-09; просмотров: 710;











