Термодинамические основы процесса кристаллизации.
Кристаллизация может происходить как при переходе из жидкого состояния в твердое, так и в твердом состоянии при переходе из одной аллотропической формы в другую. Во втором случае такое превращение носит название фазовая перекристаллизация.
Основной причиной и движущей силой процесса кристаллизации является стремление вещества к устойчивому в термодинамическом отношении, состоянию, т.е. к наименьшему запасу свободной энергии (рис. 2.4).
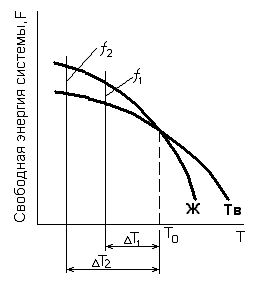
Рис. 2.4. Зависимость изменения свободной энергии системы жидкой и твердой фаз от температуры.
При наличии фазового перехода из твердого в жидкое состояние, и наоборот, эти кривые должны пересекаться. Точка пересечения Т0 соответствует равенству свободных энергий твердой и жидкой фаз, что говорит о возможности сосуществования в металле при данных условиях как твердых, так и жидких фаз. Физический смысл температуры Т0, при которой наблюдается равенство свободных энергий твердой и жидкой фаз, выражается как температура фазового равновесия: плавление–кристаллизация.
При температуре Т1 > Т0 запас свободной энергии жидкой фазы меньше, чем твердой. В этих условиях устойчивой фазой будет жидкость. При понижении температуры ниже Т0 меньшей энергией обладает твердая фаза, которая и становится стабильной в данных условиях.
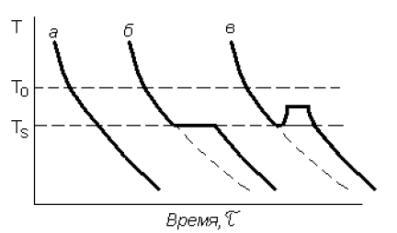 Изучение кривых охлаждения реальных металлов показывает, что затвердевание начинается не при температуре Т0 , а при ТS < Т0 (рис. 2.5).
Изучение кривых охлаждения реальных металлов показывает, что затвердевание начинается не при температуре Т0 , а при ТS < Т0 (рис. 2.5).
Рис. 2.5. Термические кривые затвердевания: а – аморфного вещества; б, в – кристаллического при различных тепловых эффектах кристаллизации
Это объясняется тем, что при образовании новой фазы должна появиться граница между двумя фазами, на что расходуется часть свободной энергии системы. В некоторых случаях для образования первых зародышей новой фазы, первых межфазных границ требуются очень значительные траты энергии, а для образования последующих частиц затраты энергии меньше. В этом случае кривые охлаждения будут иметь вид кривой в. Остановка в понижении температуры связана с выделением при кристаллизации скрытой теплоты превращения.
В некоторых случаях выделение теплоты при кристаллизации настолько велико, что температура поднимается несколько выше температуры ТS. Температура ТS носит название температуры затвердевания, разность температур ΔТ = Т0 – ТS носит название степени переохлаждения.
Необходимость переохлаждения при кристаллизации обусловлена рядом причин. Затвердевание жидкости начинается с образования зародышей очень малых размеров и приводит к образованию межфазной границы между жидкой и твердой фазами. Такая граница на начальном этапе кристаллизации характеризуется очень большой относительной протяженностью по отношению к объему формирующихся кристаллов. Известно, что любая граница является своеобразным дефектом кристаллического строения, а следовательно, обладает более высоким уровнем свободной энергии по сравнению со свободной энергией жидкости и твердой фазы.
Таким образом, образование границы – поверхности раздела требует затраты поверхностной свободной энергии ΔFоб, которая пропорциональна удельной величине поверхностного натяжения σ на границе раздела фаз и протяженности поверхности твердой частицы S:
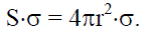
Поскольку процессы, протекающие с увеличением свободной энергии, не могут происходить самопроизвольно, то при температуре Т0 появление стабильных кристаллов оказывается невозможным.
Наличие флуктуаций энергии, однако, приводит к непрерывному появлению и исчезновению твердой фазы таким образом, что суммарная энергия системы не изменяется и процесс кристаллизации не происходит.
При понижении температуры может происходить уменьшение свободной энергии системы на величину объемной свободной энергии ΔFоб, пропорциональную удельной энергии превращения и объему твердой частицы: 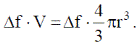 Таким образом, суммарная величина свободной энергии системы при кристаллизации
Таким образом, суммарная величина свободной энергии системы при кристаллизации 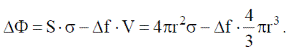 Если анализируют изменение энергии Гиббса при кристаллизации, то результирующее изменение энергии Гиббса
Если анализируют изменение энергии Гиббса при кристаллизации, то результирующее изменение энергии Гиббса 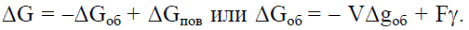 Если представить кристалл в виде куба с ребром а, то
Если представить кристалл в виде куба с ребром а, то 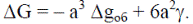 .
.
Дата добавления: 2021-12-14; просмотров: 573;











