Металлы и электролиты
В твердом виде металлы и их сплавы имеют микрокристаллическую структуру. В узлах кристаллической решетки, образованной за счет металлической связи, находятся так называемые ионы, т.е. атомы металла, валентные электроны которого принадлежат не только данному атому, но благодаря свободному их перемещению также всем остальным ионам-атомам металла.
В обычных условиях находящиеся в металле электроны не выходят из сферы металла, так как энергия электрона оказывается недостаточной для преодоления потенциального барьера на поверхности металла.
Реальная решетка металла имеет ряд искажений: пустые места в непрерывной решетке, трещины, включения газов и др. Поверхность металла является сочетанием отдельных кристаллов различной ориентации, границ между кристаллическими зернами, посторонних включений. Ионы-атомы металлов на поверхности не насыщены, что обусловливает высокие абсорбционные свойства поверхности металла. Если металлы взаимодействуют с другими элементами и образуют соли, то в таких соединениях металлы всегда существуют в виде положительных ионов.
Металлы и сплавы подразделяются на черные (железо) и цветные (цинк, олово, свинец, кобальт, висмут, никель, медь, алюминий и др.); тяжелые, имеющие плотность более 5 г/см3 (медь, цинк, ртуть, олово, марганец и др.), и легкие – плотность менее 5 г/см3 (алюминий, магний, бериллий, литий и др.); благородные (серебро, золото, платина и др.) и редкие (ванадий, вольфрам, молибден, тантал и др.).
Из важнейших для современной техники металлов, в земной коре наиболее распространены железо (5,1%), алюминий (8,8%), магний (2,1%) и титан (0,6%).
Железо занимает первое место из всех используемых металлов – 95% от общего количества используемых металлов.
В конструкциях металлических сооружений трубопроводного транспорта нефти, нефтепродуктов и газа применение находят сплавы железа (стальные трубы, резервуары, арматура и др.) и алюминия (понтоны, корпуса двигателей и др.).
Железо имеет атомную массу 55,847; плотность7,87 г/см2; температуру плавления 1536 °С; температуру кипения 3070 °С; электроотрицательность 1,8; степень окисления 0+2+3+6; цвет серебристо-белый.
Существует три модификации железа:
|
|



 a - Fe g - Fe d - Fe
a - Fe g - Fe d - Fe
a и d - железо, имеют объемноцентрированную кубическую решетку, а g - железо - гранецентрированную кубическую решетку.
Используемые в трубопроводном транспорте сплавы железа в виде сталей содержат 0,1…0,7 % С, низколегированные стали содержат добавки Ni, C, Mo и других элементов.
Алюминий имеет атомную массу 26,98; плотность - 2,698 г/см3; температуру плавления - 659 °С; температуру кипения - 2447 °С; электроотрицательность - 1,5; степень окисления - 1 +2 +3; решетку – кубической сингонии; блестящий серебристый цвет.
Алюминий обладает свойством самопассирования, защитная пленка на его поверхности может образовываться даже в отсутствие окислителей.
Алюминий амфотерен, т.е. способен в зависимости от реакции среды проявлять металлические или неметаллические свойства.
В чистом виде используется в качестве токоведущих жил, проводов и т.д. В металлоконструкциях используются сплавы алюминия: дюралюминий (Cu – 2,5…5; Mg – 0,5…0,12; Mn – 0,2…1,0), силумин (Si – 12…14); магналий (Mg – 10…30).
Электролиты представляют собой водные растворы кислот, оснований и солей, содержащих ионы диссоциированных веществ.
Вода (окись водорода Н2О) является простейшим устойчивым состоянием водорода и кислорода. Вода состоит на 88,8% из кислорода и на 11,19 % из водорода.
Кислород О имеет атомную массу 15,9994; бесцветный газ, жидкий – голубого цвета; решетка – ромбическая (a), (b) или кубическая (g); плотность - 1,4299 г/л; температура плавления – 218,8 °С; температура кипения – 183 °С.
Водород Н2 имеет атомную массу 2,02; бесцветный газ; плотность - 0,0899, температура плавления – 259,19 °С; температура кипения – 252,77 °С.
Чистая вода не имеет вкуса, запаха и цвета. Форма существования воды обусловливается соотношением температуры и давления. Вода замерзает при 0 °С и кипит при 100 °С. Плотность ее максимальна при нормальном давлении 0,1 МПа и температуре 3,98 °С; выше и ниже этой температуры плотность уменьшается. При замерзании плотность воды уменьшается, и она расширяется (примерно на 10%).
Вода имеет аномально высокие теплоту плавления и удельную тепло-емкость. Зависимость вязкости воды при температуре 0°С – 1,787×10-3 Па×с, при 20 °С – 1,002×10-3 Па×с. Аномальна зависимость теплопроводности от температуры, увеличивающейся с ее ростом. Теплопроводность жидкой воды при 0 °С – 0,5028 Вт/(м×°С); при 20 °С – 0,59917 Вт/(м×°С).
В электрическом отношении молекула воды ведет себя как диполь, т.е. как система из двух одинаковых по величине и противоположных по знаку электрических зарядов q, находящихся на расстоянии l друг от друга. Дипольный момент m = q×l характеризует полярность молекулы. При растворении веществ, имеющих ионные кристаллические решетки в воде, обладающей высокой электрической проницаемостью, ионы, составляющие поверхностный слой решетки, и дипольные молекулы воды взаимно притягиваются. Взаимодействие между ними может быть столь сильным, что атомы теряют связь с кристаллической решеткой и переходят в воду, образуя ион-атом, несущий заряд. Перешедший в раствор ион-атом окружен ориентирующимися вокруг него молекулами воды.
Воздействие иона на ближайшие молекулы растворителя (воды), которые при этом теряют независимое поступательное движение и движутся вместе с ионом как единая кинетическая единица, называется сольватацией.
Взаимодействие ионов с диполями воды обусловливает явление гидратации, т. е. образование вокруг каждого иона оболочки из диполей воды.
Таким образом, диссоциация растворимых веществ на ионы образует электролиты.
Химически чистая вода в очень незначительной степени способна диссоциировать на ионы гидроксония (Н3О+) и гидроксила (ОН-). Ион гидроксония – это гидратированный ион водорода (Н+×Н2О):
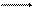
 2Н2О (Н3О+) + (ОН-).
2Н2О (Н3О+) + (ОН-).
Для практических целей вместо иона гидроксония пишут ион водорода (Н+):

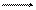 Н2О (Н+) + (ОН-).
Н2О (Н+) + (ОН-).
Концентрация Н-ионов в чистой воде при 25°С равна Сн = 1×10-7. Отрицательный логарифм концентрации ионов водорода lg(Н+) называется водородным показателем (рН) и является удобной характеристикой свойств раствора. Для воды рН = - lg1×10-7 = 7.
При значениях рН < 7 среда кислая, при значениях рН > 7 – щелочная. Шкала измерений рН обычно имеет диапазон от 0 до 14.
Дата добавления: 2021-11-16; просмотров: 454;











