ОСНОВНЫЕ ФОРМЫ СОВЕРШАЕМОЙ РАБОТЫ ПРИ ВЗРЫВЕ
Лекция № 6
Основные понятия и законы термохимии и термодинамики взрывчатых превращений.
ОСНОВНЫЕ ФОРМЫ СОВЕРШАЕМОЙ РАБОТЫ ПРИ ВЗРЫВЕ
Химическая термодинамика изучает химические реакции и физико-химические процессы с помощью термодинамических методов. Она исследует возможность или невозможность протекания в системе строго определенных реакций, описанных уравнением, точно характеризующим начальное и конечное состояние системы. Промежуточные состояния не исследуются, не изучается и механизм реакций.
Основные задачи термодинамики:
- определение тепловых эффектов реакций;
- установление условий возможности или невозможности их протекания в том или ином направлении;
- установление условий, при которых возможно химическое равновесие между компонентами в системе.
Специфической особенностью термодинамического подхода является то, что термодинамическая невозможность есть вывод окончательный, а термодинамическая возможность не всегда означает осуществимость реакции.
Уравнение, связывающее термодинамические параметры системы в равновесном состоянии, называется уравнением состояния.
Общий вид:
φ (P,V,T)=O
Уравнение состояния идеальных газов:
PV=nRT (Уравнение Менделеева-Клайперона)
1-й закон термодинамики. Представляет собой формулировку обобщённого закона сохранения энергии для термодинамических процессов. В наиболее простой форме его можно записать как dU = d'A + d'Q, где dU есть полный дифференциал внутренней энергии системы, а d'Q и d'A есть элементарное количество теплоты и элементарная работа, совершенная над системой соответственно.
2-й закон термодинамики: Второй закон термодинамики исключает возможность создания вечного двигателя. Имеется несколько различных, но в тоже время эквивалентных формулировок этого закона. 1 - Постулат Клаузиуса. Процесс, при котором не происходит других изменений, кроме передачи теплоты от горячего тела к холодному, является необратимым, то есть теплота не может перейти от холодного тела к горячему без каких либо других изменений в системе. Это явление называют рассеиванием или дисперсией энергии. 2 - Постулат Кельвина. Процесс, при котором работа переходит в теплоту без каких либо других изменений в системе, является необратимым, то есть невозможно превратить в работу всю теплоту, взятую от источника с однородной температурой, не проводя других изменений в системе.
3-й закон термодинамики: Теорема Нернста: Энтропия любой системы при абсолютном нуле температуры всегда может быть принята равной нулю.
Что такое энтропия? Ответ: От греческого entropia -- поворот, превращение. Понятие энтропии впервые было введено в термодинамике для определения меры необратимого рассеяния энергии.
Энтропия -- это функция состояния, то есть любому состоянию можно сопоставить вполне определенное (с точность до константы -- эта неопределенность убирается по договоренности, что при абсолютном нуле энтропия тоже равна нулю) значение энтропии.
Поэтому энтропия адиабатически изолированной (нет подвода или отвода тепла) системы при необратимых процессах может только возрастать.
Используя понятие энтропии Клаузиус (1876) дал наиболее общую формулировку 2-го начала термодинамики: при реальных (необратимых) адиабатических процессах энтропия возрастает, достигая максимального значения в состоянии равновесия (2-ое начало термодинамики не является абсолютным, оно нарушается при флуктуациях).
Подводим итог: Что бы мы не делали -- энтропия увеличивается, следовательно любыми своими действиями мы увеличиваем хаос, и, следовательно, приближаем "конец света". Вероятно, можно точно подсчитать, когда он, то есть "конец света", наступит, но я думаю, что ближайшие несколько миллиардов лет можно об этом не беспокоиться.
Следствием первого закона термодинамики (закона сохранения энергии) является следующее.
Изменение внутренней энергии ΔU при химической реакции может сопровождаться в общем случае отдачей тепла Q во внешнюю среду и совершением работы А против внешней среды.
ΔU = U2-U1 = Q-A = Q – pΔV = Q- P(V2-V1)
U2, U1 – внутренняя энергия продуктов реакции и исходных веществ.
Р – давление, при котором находится система.
V2, V1 – объёмы продуктов реакции и исходных веществ.
Если реакция протекает при постоянном объеме (изохорный процесс), то Q v = ΔU, т.е. тепловой эффект такой реакции равен изменению внутренней энергии.
Если реакция протекает при постоянном давлении (изобарный процесс), то
Qp=ΔU+A=U2-U1+P(V2-V1)=(U2+PV2)-(U1+PV1)
В термодинамике величину U+PV называют энтальпией и обозначают Н.
Q p =H2-H1=ΔH
| H = U + PV |
Энтальпия системы (от греч. enthalpo нагреваю), однозначная функция H состояния термодинамической системы при независимых параметрах энтропии S и давлении P, связана с внутренней энергией U соотношением
где V – объем системы.
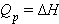
|
В химии чаще всего рассматривают изобарические процессы (P = const), и тепловой эффект в этом случае называют изменением энтальпии системы или энтальпией процесса:
| ΔH = ΔU + PΔV |
Энтальпия имеет размерность энергии (кДж). Ее величина пропорциональна количеству вещества; энтальпия единицы количества вещества (моль) измеряется в кДж∙моль–1.
В термодинамической системе выделяющуюся теплоту химического процесса условились считать отрицательной (экзотермический процесс, ΔH < 0), а поглощение системой теплоты соответствует эндотермическому процессу, ΔH > 0.
Уравнения химических реакций с указанием энтальпии процесса называют термохимическими. Численные значения энтальпии ΔH указывают через запятую в кДж и относят ко всей реакции с учетом стехиометрических коэффициентов всех реагирующих веществ. Поскольку реагирующие вещества могут находиться в разных агрегатных состояниях, то оно указывается нижним правым индексом в скобках: (т) – твердое, (к) – кристаллическое, (ж) – жидкое, (г) – газообразное, (р) – растворенное. Например, при взаимодействии газообразных H2 и Cl2 образуются два моля газообразного HCl. Термохимическое уравнение записывается так:
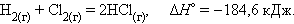
|
При взаимодействии газообразных H2 и O2 образующаяся H2O может находиться в трех агрегатных состояниях, что скажется на изменении энтальпии:
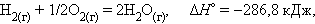
|
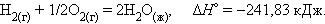
|
Приведенные энтальпии образования (реакций) отнесены у стандартным условиям температуры и давления (T = 298 K, P = 101,325 кПа). Стандартное состояние термодинамической функции, например, энтальпии, обозначается нижним и верхним индексами: 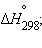 нижний индекс обычно опускают: Δ
нижний индекс обычно опускают: Δ 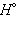 .
.
То есть, тепловой эффект химической реакции при постоянном давлении равен изменению энтальпии при реакции.
Реакции с выделением тепла называются экзотермическими, с поглощением эндотермическими. Существует две системы знаков тепловых эффектов. В старой системе используют понятие теплота (реакции, сгорание и т.д.), в ней экзотермический тепловой эффект положителен. В новой эгоистической системе тепловые эффекты рассматривают с точки зрения системы. Поэтому экзотермический эффект в ней отрицательный (система отдает тепло).
В этой системе чаще используют понятие энтальпии. Энтальпия экзотермической реакции отрицательна (- ΔН0).
Пример: CH4 + 2O2→ CO2 +2H2O
-74,9 2х0 (-393,5) 2х(-241,8)газ
-74,9 -877,1
ΔН=Н2-Н1= -877,1-(-74,9)=-802,2 кДж
Реакция идет с выделением тепла (экзотермическая).
Вывод: термодинамически возможно протекание реакции в форме горения или детонации, но это не достаточное условие.
Кроме того, из первого закона термодинамики вытекает то, что изменение внутренней энергии круговых процессов равно нулю.
А это значит что, при разложении сложного вещества на простые элементы поглощается такое же количество тепла, какое выделяется при его образовании из них.
Другой, ещё более важный закон термодинамики, вытекающий из первого закона термодинамики, был открыт петербургским профессором
Г. И. Гессом ещё в 1840 году.
Закон Гесса
Количество тепла, выделяющееся или поглощающееся при химических реакциях, зависит только от начального или конечного состояния веществ, участвующих в реакциях, а не от пути, каким вещества перешли из начального в конечное состояние.
Оговорка: баланс работы должен быть равен нулю. Обязательным условием при проведении расчетов по закону Гесса является написание уравнения. Кроме того, закон является вполне строгим лишь для процессов, протекающих либо при постоянном давлении, либо при постоянном объеме.
Из вышесказанного видно, что закон Гесса позволяет обращаться с термохимическими уравнениями как с алгебраическими, т. е. складывать и вычитать их, если термодинамические функции относятся к одинаковым условиям.
Например, диоксид углерода можно получить прямым синтезом из простых веществ (I) или в две стадии через промежуточный продукт (II):
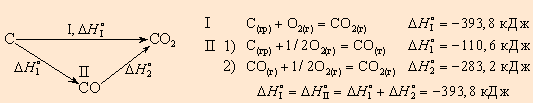
Закон Гесса позволяет очень точно определить тепловые эффекты достаточно сложных изменений системы исходя из других изменений в этой же системе.
Q0обр.пр.сгор.=Q0обр.вещества+Q0сгор.
Например, весьма сложно определить теплоту образования сложных химических соединений. Но если сжечь это вещество и замерить теплоту сгорания, то, зная продукты сгорания и теплоты их образования, можно очень точно рассчитать теплоту образования вещества.
Именно так на практике через теплоту сгорания и определяют теплоты образования сложных веществ.
Дата добавления: 2021-11-16; просмотров: 501;











