Электрофорез макромолекул. Электрофоретические методы.
Движение частиц в жидкой фазе под действием электрического поля называется, электрофорезом. Скорость движения макромолекул в электрическом поле можно использовать для определения молекулярной массы белков, для идентификации макромолекул по заряду, по форме, для определения изменений в первичной структуре, а также для количественного разделения различных видов макромолекул.
Рассмотрим коротко теоретические основы электрофореза. На макромолекулы с суммарным зарядом q в электрическом поле с напряженностью Е действует электрическая сила
Fэ = qE
Под действием этой силы происходит ускоренное движение макромолекул. В результате такого движения возникает сопротивление вязкой среды с силой трения Fc = fv, где v – скорость движения макромолекул. Через определенное время, когда силы уравновешиваются (Fэ = Fc), наступает стационарное состояние, и макромолекулы движутся с постоянной скоростью v . Тогда
qE = fv
Отношение скорости v к напряженности электрического поля Е называется электрофоретической подвижностью u. Из (3.45)
u =v/E = q/f
Электрофоретическая подвижность измеряется в м2•В-1•с-1. Для сферических макромолекул f = 6πηr, тогда
u= q/6πηr
где η– вязкость среды; г–радиус макромолекулы.
Как видно, коэффициент электрофоретической подвижности, дает информацию о радиусе макромолекулы, соответственно, и о ее размерах. Однако среда, в которой происходит движение заряженных частиц, является не изолятором, а электролитом, состоящим из различных ионов. Это обстоятельство вносит большие затруднения для теоретического описания движения заряженной частицы в электрическом поле. Макромолекула в растворе электролита окружена ионной оболочкой, экранирующей ее от приложенного электрического поля. Ионная оболочка частично нарушается как действием электрического поля, так и при движении частицы. Существующая теория электрофореза пока не в состоянии точно описать эти ( ряд других) процессов, и поэтому данные электрофореза не могут трактоваться с точки зрения информации о макромолекулярной структуре. Но, тем не менее, различные варианты электрофореза широко применяются для аналитических и препаративных целей. Методы препаративного электрофореза разработаны для получения относительно больших количеств чистого (гомогенного) материала. Аналитический электрофорез используется для контроля чистоты препаратов, определения количества компонентов в смеси, оценки их соотношения и т. д. На практике оптимальные условия для электрофореза тех или иных препаратов подбираются в большинстве случаев эмпирическим путем.
Для разделения макромолекул электрофорезом используют специальные приборы. Существуют три основных типа электрофореза: с подвижной границей, зональный и непрерывный.
При электрофорезе с подвижной границей макромолекулы присутствуют во всем обьеме раствора и положение молекул с течением времени можно определять оптическими методами.
В зональном электрофорезе раствор препарата наносят в виде пятна или полосы, и частицы мигрируют через растворитель. Растворитель обычно содержится в гомогенной инертной среде ( бумага, гель).
В непрерывном электрофорезе образец также наносят в виде зоны, но раствор наносится не однократно, а прибавляется постоянно по мере проведения электрофореза.
Наибольшее применение на практике нашли различные модификации зонального электрофореза с различными носителями: на бумаге, на ацетате целлюлозы, на геле. Два остальных типа электрофореза используются сравнительно редко. Рассмотрим более подробно один из методов зонального электрофореза – гель-электрофорез, нашедший наиболее широкое применение в исследовании макромолекул.
Гель-электрофорез
Лучшие результаты при электрофоретическом разделении белков и нуклеиновых кислот достигаются при использовании в качестве носителя гелей из крахмала, полиакриламида, агарозы и комбинированных гелей из этих веществ. Качественное разделение макромолекул при использовании этих носителей достигается тем, что эффект электрофоретического разделения дополняется разделяющим действием гель-проникающей хромотаграфии (эффект «молекулярного сита»). Первоначально для гель-электрофореза применяли крахмальный гель, однако, в настоящее время его заменили полиакриламидные и агарозные гели. Полиакриламид оказался наиболее эффективным носителем для электрофореза белков и небольших молекул РНК, например т-РНК. Это связано с тем, что в полиакриламидном геле можно контролировать эффект молекулярного сита ( размер пор в геле ) с помощью изменения концентрации геля. Для нуклеиновых кислот, размер молекул которых больше размеров пор полиакриламида, используются агарозные или агарозно-полиакриламидные гели. Полиакриламидный гель получается при сшивании акриламида с метилен-бис-акриламидом. Такой гель готовят непосредственно перед экспериментом в контейнере ( стеклянная трубка, пластина) для проведения электрофореза (Рис. 9). После окончания электрофоретического разделения, зоны распределения макромолекул в геле обнаруживают путем окрашивания специфическими красителями и или другими способами. Например, для обнаружения белков используются красители амид черный, бромфеноловый синий, Кумасси бриллиантовый голубой. Если разделяются биологически активные молекулы, положение молекулы можно идентифицировать по измерению активности, например, по измерению ферментативной активности. Локализацию нуклеиновых кислот в гелях определяют после обработки флоуресцентными красителями (например, бромид этидия) или по радиоактивности разделенных фрагментов.
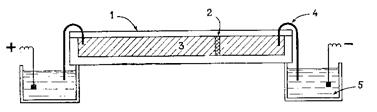
Рис.. 9. Устройство для электрофореза на горизонтальных пластинах геля ( Фрайфельдер, с.229)
1. Пластина геля; 2. охлаждающая подложка; 3. отсек для буферного раствора; 4. бумажный электрод между гелем и буфером; 5. циркуляционный термостат с охлаждающей жидкостью; 6. электроды; 7. источник электрического тока
Электрофорез в полиакриламидном геле проводят или в колонках (трубках) с гелем или на пластинах с гелем. Рассмотрим один из вариантов этого метода, наиболее широко используемых для разделения белков .
ДСН-гель-электрофорез. Для определения молекулярной массы белков используют электрофорез в присутствии додецилсульфата натрия в полиакриламидном геле. Этот метод предложили в 1969 году Клаус Вебер и Мери Осборн.
До проведения электрофореза белок обрабатывают 1 % раствором додецилсульфата натрия (ДСН) с 0,1 М β-меркаптоэтанолом при нейтральном рН. В таком растворе большинство многоцепочечных белков связываются с ДСН и диссоциируют, дисульфидные связи разрываются, вторичная структура белка исчезает.
Рис. 10. Типичная полулогарифмическая зависимость М от электрофоретической подвижности uпри определениимолекулярной массы ДСН-электрофорезом в ПАА-геле.
а – комплекс полипептидной цепи (1) с молекулами ДСН (2); б– полулогарифмическая зависимость молекулярной массы М от относительной электрофоретической подвижности u. Маркерные белки: 1–фосфолипаза А, 2 – трансферин, 3 – каталаэа, 4 – овальбумин, 5 – пепсин, 6 – химотрипсиноген
Додецилсульфат натрия совершенно одинаково связывается с молекулами различных белков: 1,4 кг ДСН связывается с 1 кг белка. Каждая молекула ДСН несет один отрицательный заряд и, таким образом, общая плотность заряда примерно одинаковая для разных белков. Таким образом, поверхностная шуба из молекул ДСН устраняет зарядовые различия, существующие в нативных белках. После обработки ДСН, полипептидная цепь представляет вытянутый цилиндр с диаметром 1,8 нм. Длина таких стержней коррелирует с молекулярной массой белков: чем длиннее цилиндр, тем больше молекулярная масса (рис. 1, а). Обработанные таким образом белки имеют одну и ту же форму и одинаковое отношение заряд/масса. Электрофоретическая подвижность таких молекул будет зависеть только от молекулярной массы вследствие движения в молекулярном сите.
В качестве носителя при электрофорезе используют полиакриламидный гель в концентрации от 5 до 15 %. Экспериментально установлена линейная связь между электрофоретической подвижностью и логарифмом молекулярной массы:
u = b–a/lgM
где а и b – постоянные величины, зависящие от свойств полиакриламидного геля.
Определение молекулярной массы исследуемого белка проводят по калибровочной кривой. Для построения калибровочной кривой в идентичных условиях проводится электрофорез маркерных белков с известной молекулярной массой и строится зависимость u = f (lgM) (рис. 1, б). По значению электрофоретической подвижности на калибровочной кривой с высокой точностью (до 5 %) находят молекулярную массу исследуемого белка.
Кроме измерения молекулярной массы, ДСН-гель- электрофорез позволяет определить и идентифицировать субъединичное строение сложных белков, имеющих четвертичную структуру.
Изоэлектрическое фокусирование белков.
Белковые молекулы являются амфолитами, т.е. содержат положительно и отрицательно заряженные группировки. Для таких молекул характерна зависимость их заряда от рН . При низких значениях рН отрицательные заряженные группировки молекулы нейтрализуются ионами Н+ и в целом она имеет положительный заряд. При высоких значениях рН такие молекулы заряжены отрицательно, т.к. положительно заряженные группировки молекулы нейтрализуются ионами гидроксила. Для каждого амфолита существует такое значение рН, при котором заряд молекулы равен нулю. Это значение рН называется изоэлектрической точкой рI молекулы. При электрофорезе в градиенте рН молекулы белков будут двигаться до тех пор, пока не достигнут области геля, где рН геля будет равен значению рI молекулы. В этой точке заряд молекулы будет равен нулю, т.е. она станет незаряженной и перестанет двигаться. В случае разгонки смеси белков, каждый белок остановится в той области градиента рН, которая соответствует значению изоэлектрической точки соответствующей молекулы (рис 11). Такой метод разделения белков в градиенте рН, основанный на различиях значений изоэлектрических точек, называется изоэлектрическим фокусированием. Для создания стабильного градиента рН в состав геля добавляют синтетические низкомолекулярные полиамфолиты (многозарядные молекулы с м.м. 300-600). Полиамфолиты представляют собой смесь полимеров алифатических амино- и карбоновых кислот, например, амфолины фирмы LKB. Меняя соотношение различных амфолитов, можно приготовить гель с соответствующим, для определенных белковых молекул, интервалом градиента рН. При приложении на гель электрического поля начинается движение полиамфолитов и через определенное время устанавливается градиент рН
Изоэлектрическое фокусирование по сравнению с электрофорезом характеризуется более высокой разрешающей способностью разделения и возможностью концентрации разделяемых фракций. В последние годы появились методы, комбинирующие оба способа разделения белковых молекул. На гелевых пластинах в одном направлении проводят разделение электрофорезом, в другом, перпендикулярном направлении – изоэлектрическим фокусированием. За счет такого двумерного разделения, разрешающая способность метода резко возрастает, что делает возможным разделение компонентов, которое нельзя осуществить другими методами.
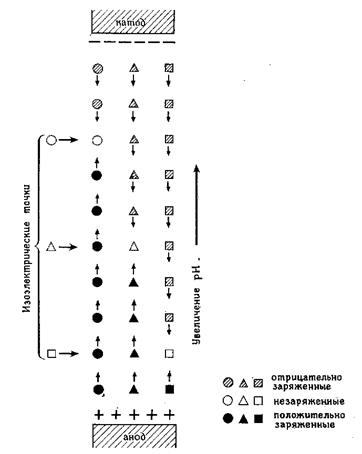
Рис. 11. Принцип электрофоретического разделения заряженных молекул в градиенте рН ( метод изоэлектрического фокусирования ) . (Фрайфельдер,240с)
Дата добавления: 2018-05-10; просмотров: 2983;











