Тема 1.3 Основные положения теории химического строения
А.М. Бутлерова
Основой современной органической химии является теория строения органических соединений, созданная на базе теории химического строения
А. М. Бутлерова и электронных (квантовохимических) представлений о строении атома и природе химической связи.
Основные положения теории химического строения А. М. Бутлерова:
1. Атомы в молекулах соединены друг с другом в определенной последовательности согласно их валентностям. Последовательность межатомных связей в молекуле называется ее химическим строением и отражается одной структурной формулой (формулой строения).
2. Химическое строение можно устанавливать химическими методами. (В настоящее время используются также современные физические методы).
3. Свойства веществ зависят от их химического строения.
4. По свойствам данного вещества можно определить строение его молекулы, а по строению молекулы – предвидеть свойства.
5. Атомы и группы атомов в молекуле оказывают взаимное влияние друг на друга.
Теория Бутлерова явилась научным фундаментом органической химии и способствовала быстрому ее развитию. Опираясь на положения теории, ученый дал объяснение явлению изомерии, предсказал существование различных изомеров и впервые получил некоторые из них. Развитию теории строения способствовали работы Кекуле, Кольбе, Купера, Жерара и Вант-Гоффа. Однако их теоретические положения не носили общего характера и служили главным образом целям объяснения экспериментального материала.
Современная теория строения позволяет предсказывать основные химические и физические свойства органических соединений, исходя из их химического, пространственного и электронного строения. Теория строения играет ключевую роль в изучении и систематизации огромного фактического материала органической химии и открывает широкие возможности для получения веществ с заданными свойствами.
Наиболее распространенные в органических соединениях элементы (элементы-органогены) относятся в основном ко 2-му (C, N, O) и 3-му (P, S, Cl) периодам Периодической системы. Валентными электронами этих элементов являются 2s-, 2р- и 3s-, 3р-электроны соответственно.
В органических соединениях ковалентная связь является основной. Ковалентная связь возникает между атомами с относительно малыми различиями в электроотрицательностях (Δχ < 2), например, С и Н, С и О, С и N, C и Cl, N и O и т. п., которые образуют химическую связь за счет общей электронной пары:
Н:Н С:С С:Н С:О.
Формула строения (структурная формула) описывает порядок соединения атомов в молекуле, т. е. ее химическое строение. Химические связи в структурной формуле изображают черточками. Связь между водородом и другими атомами обычно не указывается (такие формулы называются сокращенными структурными формулами).
Например, полная (развернутая) и сокращенная структурные формулы изобутана C4H10 имеют вид:
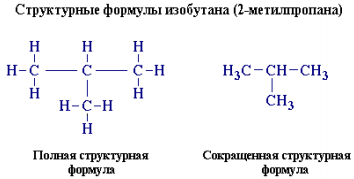
Часто используется еще более краткая запись формулы, когда не изображают не только связи с атомом водорода, но и символы атомов углерода и водорода. Например, строение бензола C6H6 отражают формулы:
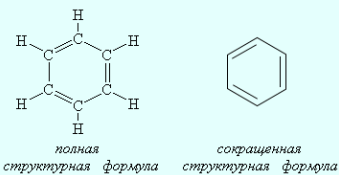
Структурные формулы отличаются от молекулярных (брутто) формул, которые показывают только, какие элементы и в каком соотношении входят в состав вещества (т. е. качественный и количественный элементный состав), но не отражают порядка связывания атомов.
Например, н-бутан и изобутан имеют одну молекулярную формулу C4H10, но разную последовательность связей. Таким образом, различие веществ обусловлено не только разным качественным и количественным элементным составом, но и разным химическим строением, которое можно отразить лишь структурными формулами:
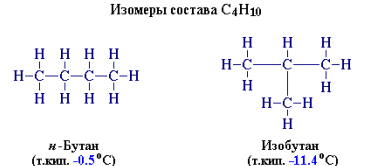
Еще до создания теории строения были известны вещества одинакового элементного состава, но c разными свойствами. Такие вещества были названы изомерами, а само это явление – изомерией. В основе изомерии, как показал
А. М. Бутлеров, лежит различие в строении молекул, состоящих из одинакового набора атомов. Изомеры – это вещества, имеющие одинаковый качественный и количественный состав (одинаковую формулу), но разное строение Таким образом, изомерия – это явление существования соединений, имеющих одинаковый качественный и количественный состав, но различное строение и, следовательно, разные свойства. В зависимости от характера отличий в строении изомеров различают структурную и пространственную изомерию.
Типы изомерии:
1. Структурная.
2. Пространственная: а) геометрическая; б) оптическая.
Структурные изомеры – соединения одинакового качественного и количественного состава, отличающиеся порядком связывания атомов, т. е. химическим строением. Следовательно, структурные изомеры имеют одну и ту же молекулярную формулу, но различные структурные формулы.
Изомерия углеродного скелета. Например, структурные изомеры C5H12:
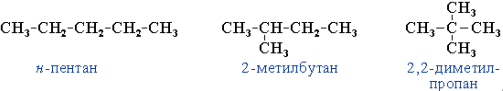
Изомерия положения:
а) кратных связей

б) функциональной группы

Межклассовая изомерия (изомерия функциональных групп)

Пространственные изомеры (стереоизомеры) при одинаковом составе и одинаковом химическом строении различаются пространственным расположением атомов в молекуле. Пространственными изомерами являются оптические и цис-транс изомеры (шарики разного цвета обозначают разные атомы или атомные группы):
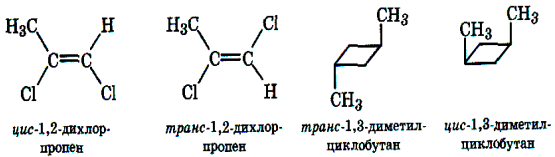
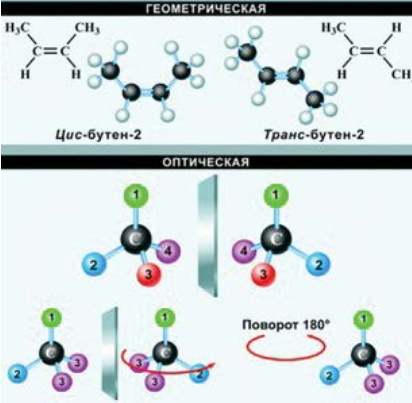
Рисунок 1.4 - Геометрическая и оптическая изомерия
Молекулы таких изомеров несовместимы в пространстве. Наглядное представление о пространственном строении молекул дают их трехмерные модели. Для графического изображения стереоизомеров используются стереохимические и проекционные формулы. Стереоизомерия играет важную роль в органической химии. Подробнее эти вопросы рассматриваются при изучении соединений отдельных классов.
Изомеры, образующиеся за счет свободного вращения вокруг простых связей, носят название конформеров.
Многочисленные реакции, протекающие в живой клетке или в пробирке, разделяются на несколько классов по их механизму. На простых примерах здесь показано значение разных типов реакций в органической химии. На схеме приведены лишь исходные соединения и конечные продукты реакции. В реакциях органических соединений, как правило, изменения затрагивают только часть молекулы, ее основная конструкция (углеродный скелет) сохраняется. Например:
CH2 = CH2 + H2O CH3–CH2OH
этилен этанол
В случае неорганических реакций более характерен распад соединения на ионы или атомы, из которых образуются совершенно новые конструкции: Большинство органических реакций протекают значительно медленнее реакций неорганических веществ и обычно не завершаются полностью вследствие их обратимости. Многие органические реакции включают несколько элементарных стадий. Последовательность нескольких реакций принято изображать в виде схемы превращений, в которой действующий на органическое соединение реагент записывается над стрелкой, а выделяющийся побочный продукт – под стрелкой со знаком «минус»:
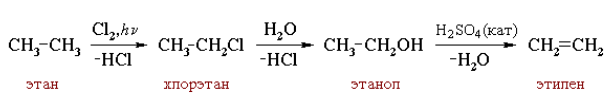
Многие органические реакции являются сложными и идут в несколько элементарных стадий (последовательных или параллельных). Общая скорость сложной химической реакции определяется скоростью ее наиболее медленной (лимитирующей) стадии. Лимитирующей является стадия с более высокой энергией активации Еа'. В случае сложных реакций на некоторых стадиях образуются нестабильные промежуточные частицы – органические ионы или свободные радикалы. Их относительная устойчивость и, следовательно, вероятность образования растут с увеличением возможности делокализации (рассредоточения) заряда в ионе или неспаренного электрона в радикале.
Классификацию органических реакций проводят на основе общих для всех реакций признаков: строение и состав исходных и конечных продуктов; изменение степеней окисления реагирующих частиц; тепловой эффект реакции; ее обратимость и т. п. Наиболее часто органические реакции классифицируют по следующим признакам:
- по конечному результату реакции (на основе сопоставления строения исходных и конечных продуктов);
- по минимальному числу частиц, участвующих в элементарной реакции;
- по механизму разрыва ковалентных связей в реагирующих молекулах.
Тип многостадийных реакций определяют по самой медленной (лимитирующей) стадии. Различные способы классификации часто сочетаются друг с другом.
В основе этой классификации лежит сопоставление числа, состава и строения исходных и конечных продуктов по уравнению реакции. В соответствии с конечным результатом различают следующие типы органических реакций:
- замещение;
- присоединение;
- отщепление (элиминирование);
- изомеризация (перегруппировка);
- разложение.
Если процесс сопровождается изменением степени окисления атома углерода в органическом соединении, то выделяют также реакции окисления и восстановления. Окисление и восстановление органических веществ может проходить по какому-либо из названных выше типов реакций.
1. Реакции замещения.
Атом или атомная группировка в молекуле органического соединения замещается на другой атом (или атомную группировку):
АВ + С → АС + В.
Реакции этого типа можно рассматривать как реакции обмена, но в органической химии предпочтительней термин «замещение», поскольку в обмене участвует (замещается) лишь меньшая часть органической молекулы. Примеры:
- хлорирование этана:
C2H6 + Cl2 (на свету) → CH3CH2Cl + HCl;
- щелочной гидролиз хлорэтана:
CH3CH2Cl + KOH (водн. р-р) → CH3CH2OH + KCl.
2. Реакции присоединения.
В реакциях присоединения молекула органического соединения и молекула простого или сложного вещества соединяются в новую молекулу, при этом другие продукты реакции не образуются:
А + В → С.
Примеры:
- бромирование пропена:
CH2 = CH – CH3 + Br2 → CH2Br – CHBr – CH3;
- гидратация этилена:
CH2=CH2 + H2O → CH3CH2OH.
К реакциям присоединения относятся также реакции полимеризации:
n A → An.
Например, образование полиэтилена:
nCH2 = CH2 → (–CH2–CH2–)n.
3. Реакции отщепления.
В реакции отщепления (элиминирования) происходит отрыв атомов или атомных групп от молекулы исходного вещества при сохранении ее углеродного скелета:
А → В + С.
Например:
- отщепление хлороводорода при действии на хлоралкан спиртовым
раствором щелочи (дегидрохлорирование хлорэтана):
CH3–CH2Cl → CH2=CH2 + HCl;
- отщепление воды при нагревании спирта с серной кислотой (дегидратация этанола):
CH3–CH2OH → CH2=CH2 + H2O;
- отщепление водорода от алкана в присутствии катализатора (дегидрирование этана):
CH3–CH3 → CH2=CH2 + H2.
4. Реакции изомеризации или перегруппировки.
В органическом соединении происходит переход (миграция) от дельных атомов или групп атомов от одного участка молекулы к другому без изменения ее качественного и количественного состава:
А→В.
В этом случае исходное вещество и продукт реакции являются изомерами (структурными или пространственными). Например, в результате перегруппировки может изменяться углеродный скелет молекулы:
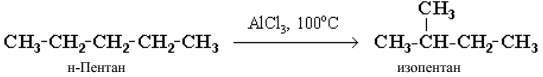
5. Реакции разложения.
В результате реакции разложения из молекулы сложного органического вещества образуется несколько менее сложных или простых веществ:
А → В + С + . . .
К этому типу реакций относится процесс крекинга – расщепление углеродного скелета крупных молекул при нагревании и в присутствии катализаторов:
CnH2n+2 → CmH2m+2 + CpH2p (n = m + p);
например, C10H22 → C5H12 + C5H10.
Реакции разложения при высокой температуре называют пиролизом, например:
СН4 → C + 2H2, пиролиз метана (1000 0C).
6. Реакции окисления и восстановления.
Окислительно-восстановительные реакции – реакции, в ходе которых меняется степень окисления атомов, входящих в молекулу. Для органических реакций этого типа применимы те же законы, что и для неорганических. Отличием является то, что в органической химии окислительно-восстановительные процессы рассматриваются, прежде всего, по отношению к органическому веществу и связываются с изменением степени окисления углерода, являющегося реакционным центром молекулы. Эти реакции могут проходить по типу реакций присоединения, отщепления, замещения и т. п. Если атом углерода в органической молекуле окисляется (отдает электроны более электроотрицательному атому), то этот процесс относят к реакциям окисления, так как продукт восстановления окислителя (обычно неорганическое вещество) не является конечной целью данной реакции. И наоборот, реакцией восстановления считают процесс восстановления атома углерода в органическом веществе.
Дата добавления: 2018-05-10; просмотров: 2460;











