Этиленовые углеводороды, алкены
Общие сведения, номенклатура этиленовых углеводородов
Алкены – ненасыщенные углеводороды, молекулы которых содержат одну двойную связь. Общая формула предельных углеводородов CnH2n.Простейший представитель ряда - этилен СH2=CH2. Согласно система-тической номенклатуре названия этиленовых углеводородов производят из названий соответствующих алканов с заменой суффикса -ан на –ен. Алкены простого строения называют заменяя суффикс -ан на -илен.
Алкены применяются в качестве исходных продуктов в производстве полимерных материалов (пластмасс, каучуков, пленок) и других органических веществ.
Таблица 5. Гомологический ряд этиленовых углеводородов
| Предельные углеводороды | Этиленовые углеводороды |
| Метан СН4 | - |
| Этан С2Н6 | Этен (этилен) С2Н4 |
| Пропан С3Н8 | Пропен (Пропилен) С3Н6 |
| Бутан С4Н10 | Бутен (бутилен) С4Н8 |
| Пентан С5Н12 | Пентен (амилен) С5Н10 |
| Гексан С6Н14 | Гексен (гексилен) С6Н12 |
| и.т.д. | и.т.д. |
Углеводородные радикалы, образованные от алкенов: -CH = CH2 – винил и
–СН2-СН = СН2 – аллил.
Изомерия алкенов
Для алкенов, начиная с бутена, характерно несколько видов изомерии:
1) изомерия углеродного скелета:
CH2 = CH-CH2-CH3 (бутен-1)
СН2-С(СН3)-СН3 (2-метилпропен-1)
2) изомерия положения двойной связи:
CH2 = CH-CH2-CH3 (бутен-1)
CH3-CH = CH-CH3 (бутен-2)
3) пространственная изомерия:
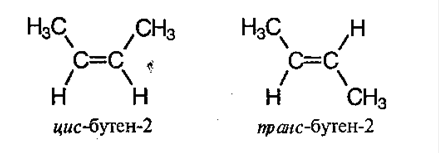
Физические свойства алкенов
При обычных условиях С2-С4 – газы, С5-С17 – жидкости, начиная с С18 – твердые вещества. Алкены не растворимы в воде, хорошо растворимы в органических растворителях.
Получение алкенов
Основные способы получения алкенов:
1. Дегидрогалогенирование галогенпроизводных алканов под действием спиртовых растворов щелочей:
CH3-CH2-CHBr-CH3 + KOH → CH3-CH = CH-CH3 + KBr + H2O
2. Дегалогенирование дигалогенпроизводных алканов под действием активных металлов
CH3-CHCl-CHCl-CH3 + Zn → ZnCl2 + CH3-CH = CH-CH3
3. Дегидратация спиртов при нагревании с серной кислотой (t >1500C) или пропускании паров спирта над катализатором
CH3-CH(OH)- CH3 → CH3-CH = CH2 + H2O
4. Дегидрирование алканов при нагревании (5000С) в присутствии катализатора (Ni, Pt, Pd)
CH3-CH2 — CH3 → CH3-CH = CH2 + H2
Дата добавления: 2021-10-28; просмотров: 632;











