Химические свойства классов органических соединений
| Алканы CnH2n+2 | 1. Реакции по С–H-связи:
1.1. Реакции свободнорадикального замещения (свет, нагрев):
CH4 + Cl2 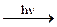 CH3Cl + HCl
CH3Cl + Cl2 CH3Cl + HCl
CH3Cl + Cl2 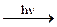 CH2Cl2 + HCl
1.2. Нитрование:
С6H14 + HNO3 CH2Cl2 + HCl
1.2. Нитрование:
С6H14 + HNO3 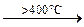 C6H13NO2 + H2O
1.3. Дегидрогенизация:
С4H10 C6H13NO2 + H2O
1.3. Дегидрогенизация:
С4H10 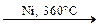 C4H8 + H2
2. Реакции окисления
2.1. Горение:
CH4 + 2O2 → CO2 + 2H2O
2.2. Каталитическое окисление (промышленное):
CH4 C4H8 + H2
2. Реакции окисления
2.1. Горение:
CH4 + 2O2 → CO2 + 2H2O
2.2. Каталитическое окисление (промышленное):
CH4 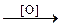 CH3OH
CH4 CH3OH
CH4 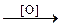 HCOH + H2O
3. Реакции по С–С-связи (крекинг):
CH4 HCOH + H2O
3. Реакции по С–С-связи (крекинг):
CH4 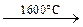 HC≡CH + H2
C4H10 HC≡CH + H2
C4H10 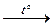 C2H6 + C2H4 C2H6 + C2H4
|
| Алкены CnH2n | 1. Горение:
H2C=CH2 + 3O2 → 2CO2 + 2H2O
2. Реакции электрофильного присоединения по связи С=С:
H3C–CH=CH2 + HBr → H3C–CHBr–CH3
H2C=CH2 + Br2 → BrCH2–CH2Br
3. Радикальная полимеризация:
nH2C=CH2 → (–CH2–CH2–)n
4. Гидратация:
H2C=CH2 + H2O 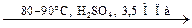 CH3–CH2–OH
5. Окисление:
3H2C=CH2 + 2KMnO4 + 4H2O → 3OH–CH2–CH2–OH + 2KOH + 2MnO2↓
6. Гидрогенизация:
H2C=CH2 + H2 CH3–CH2–OH
5. Окисление:
3H2C=CH2 + 2KMnO4 + 4H2O → 3OH–CH2–CH2–OH + 2KOH + 2MnO2↓
6. Гидрогенизация:
H2C=CH2 + H2 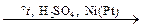 H3C–CH3
7. Радикальное галогенирование:
CH3CH=CH2 H3C–CH3
7. Радикальное галогенирование:
CH3CH=CH2 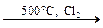 Cl–CH2CH=CH2 + HCl Cl–CH2CH=CH2 + HCl
|
| Диеновые углеводороды CnH2n-2 | 1. Реакции электрофильного присоединения H2C=CH–CH=CH2 + Br2 → Br–CH2–CH=CH–CH2–Br H2C=CH–CH=CH2 + Br2 → CH2=CH–CHBr–CH2–Br 2. Реакция полимеризации nH2C=CH–CH=CH2 → (–CH2–CH=CH–CH2–)n |
| Алкины CnH2n-2 | 1. Реакции электрофильного присоединения по С≡С-связи:
1.1. Галогенирование:
H–C≡C–H + Br2 → BrHC=CHBr + Br2 → Br2HC=CHBr2
1.2. Гидрогалогенирование:
H–C≡C–H + HBr → BrHC=CH2 + HBr → Br2HC=CH3
1.3. Гидратация:
H–C≡C–H + H2O 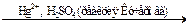 H2C=CHOH → CH3–COH
1.4. Гидрирование:
H–C≡C–H + H2 H2C=CHOH → CH3–COH
1.4. Гидрирование:
H–C≡C–H + H2 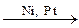 H2C=CH2 + H2 → H3C–CH3
1.5. Полимеризация:
3H–C≡C–H H2C=CH2 + H2 → H3C–CH3
1.5. Полимеризация:
3H–C≡C–H 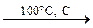 С6H6
1.6. Окисление:
H–C≡C–H + [O] С6H6
1.6. Окисление:
H–C≡C–H + [O] 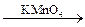 HOOC–COOH → HCOOH + CO2 HOOC–COOH → HCOOH + CO2
|
| Арены (ароматические углеводороды) | 1. Реакции электрофильного замещения:
C6H6 + Br2 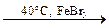 C6H5Br + HBr
С6H6 + CH3Br C6H5Br + HBr
С6H6 + CH3Br 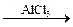 C6H5–CH3 + HBr
C6H6 + HNO3 C6H5–CH3 + HBr
C6H6 + HNO3 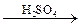 C6H5–NO2 + H2O
2. Реакции присоединения:
С6H6 + 3H2 C6H5–NO2 + H2O
2. Реакции присоединения:
С6H6 + 3H2 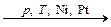 C6H12
C6H6 + 3Cl2 C6H12
C6H6 + 3Cl2 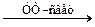 C6H6Cl6 C6H6Cl6
|
| Спирты | 1. Реакции с участием водородного атома OH–-группы:
1.1. Взаимодействие с металлами:
2R–OH + 2Na = 2R–ONa + NaOH
1.2. Реакция этерификации (с кислотами):
CH3COOH + HOCH3 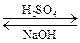 CH3–CO–O–CH3 + H2O
2. Взаимодействие с галогеноводородами:
R–OH + HBr CH3–CO–O–CH3 + H2O
2. Взаимодействие с галогеноводородами:
R–OH + HBr 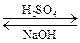 R–Br + H2O
3. Окисление спиртов:
CH3–CH2–OH + СuO → CH3–COH + H2O + Cu
4. Дегидратация:
CH3–CH2–OH R–Br + H2O
3. Окисление спиртов:
CH3–CH2–OH + СuO → CH3–COH + H2O + Cu
4. Дегидратация:
CH3–CH2–OH 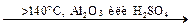 CH2=CH2 + H2O
2CH3–CH2–OH CH2=CH2 + H2O
2CH3–CH2–OH 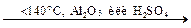 CH3–CH2–O–CH2–CH3 + H2O
H3C–CH(OH)–CH2–CH3 → CH3–CH=CH–CH3 + H2O CH3–CH2–O–CH2–CH3 + H2O
H3C–CH(OH)–CH2–CH3 → CH3–CH=CH–CH3 + H2O
|
| Фенолы | 1. Взаимодействие с металлами:
2C6H5–OH + 2Na → 2C6H5–ONa + H2↑
2. Взаимодействие со щелочами:
C6H5–OH + NaOH → C6H5–ONa + H2O
3. Взаимодействие со спиртами:
С6H5–OH + C2H5–OH → C6H5–O–C2H5 + H2O
4. Галогенирование:
С6H5–OH + 3Br3(водн) → С6H2Br3–OH + 3HBr
5. Взаимодействие с азотной кислотой (нитрование):
C6H5–OH + 3HNO3 (разб.) 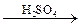 C6H2(NO2)3 + 3H2O
6. Реакция поликонденсации:
nC6H5–OH + nHCOH → nOH–C6H4–CH2–OH
nOH–C6H4–CH2–OH + C6H5OH → (–C6H4(OH)–CH2– C6H4(OH)–)n + H2O C6H2(NO2)3 + 3H2O
6. Реакция поликонденсации:
nC6H5–OH + nHCOH → nOH–C6H4–CH2–OH
nOH–C6H4–CH2–OH + C6H5OH → (–C6H4(OH)–CH2– C6H4(OH)–)n + H2O
|
| Альдегиды и кетоны CnH2nO | 1. Реакции окисления:
R–COH + Ag2O → R–COOH + 2Ag
CH3–COH + 2Cu(OH)2 → CH3COOH + Cu2O + 2H2O
2. Поликонденсация с фенолом – смотри выше.
3. Реакции восстановления водородом:
CH3–CO–CH3 + H2 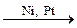 CH3–CH(OH)–CH3 CH3–CH(OH)–CH3
|
| Амины | 1. Взаимодействие с кислотами:
CH3NH2 + HCl → [CH3–NH3]Cl
2. Взаимодействие с алкилгалогенидами:
CH3NH2 + CH3I 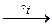 (CH3)2NH + HI → [(CH3)2NH2]I
3. Взаимодействие с органическими кислотами и ангидридами:
CH3COOH+CH3NH2→[CH3COO]–[CH3NH3]+ →CH3–CO–NH-CH3+H2O
4. Гидролиз аминов:
CH3NH2 + H2O (CH3)2NH + HI → [(CH3)2NH2]I
3. Взаимодействие с органическими кислотами и ангидридами:
CH3COOH+CH3NH2→[CH3COO]–[CH3NH3]+ →CH3–CO–NH-CH3+H2O
4. Гидролиз аминов:
CH3NH2 + H2O 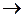 CH3NH3+ + OH–
5. Горение:
4CH3NH2 + 9O2 → 4CO2 + 10H2O + 2N2
6. Бромирование анилина:
C6H5–NH2 + 3Br2 → C6H2Br3 + 3HBr CH3NH3+ + OH–
5. Горение:
4CH3NH2 + 9O2 → 4CO2 + 10H2O + 2N2
6. Бромирование анилина:
C6H5–NH2 + 3Br2 → C6H2Br3 + 3HBr
|
Контрольные вопросы
1. Опишите, как классифицируются органические соединения в зависимости от структуры углеродного скелета. Чем отличаются карбоциклические и гетероциклические соединения?
2. Как распределяются по классам органические соединения с различными функциональными группами?
3. Сформулируйте правила номенклатуры органических соединений.
4. Что такое субстрат и реагент? Дайте определение электрофильному и нуклеофильному реагентам.
5. Приведите примеры реакций электрофильного и нуклеофильного замещения как гетеролитических реакций.
5. Рассмотрите гомолитические реакции на примере реакции радикального замещения.
6. Дайте определение и приведите пример реакции элиминирования.
7. Приведите пример реакции перегруппировки. Какими могут быть реакции перегруппировки?
Дата добавления: 2017-11-21; просмотров: 1954;











