Тестовые задания для самоконтроля
1. К алифатическим спиртам относится…
1) CH3–CH2–CH2OH,
2) CH3–CH2–CH2–CH3,
3) CH3–CH2–CH2–COOH.
2. Ациклическим аминоспиртом является…
1) CH2OH–CH2–CH2–COOH,
2) CH2OH – CH2– CH2– NH2,
3) CH3–CH2–CH(NH2)–COOH.
3. Правильное название соединения: H2ClC–CH2–C–CH3 -
║
O
1) 4-хлор-бутанол-2,
2) 1-хлор-бутанон-3,
3) 4-хлор-бутанон-2.
4. К диеновым углеводородам относится…
1) CH3–CH=CH–CH2–CH3,
2) CH3–CH=CH–CH=CH2,
3) CH3–C≡C–CH3.
5. Правильное название соединения:CH2=C–CH2–CH3 -
│
CH3
1) 2-метилбутен-1,
2) 3-метилбутен-3,
3) метилбутен.
6. Правильное название соединения:
OH
│
CH3–C–CH2–CH3
│
CH3
1) 2-метилбутанол-3,
2) 2-метилбутанон-2,
3) 2-метилбутанол-2.
7. К нуклеофильным реагентам относится
1) H+,
2) OH–,
3) Cl.
8. К электрофильным реагентам относится
1) H+,
2) CN–,
3) Cl.
9. К радикальным частицам относится…
1) H+,
2) CN–,
3) Cl·.
10. Реакция CH3–CH2–Br + OH– → CH3–CH2–OH + Br– относится к типу реакций…
1) электрофильного замещения,
2) нуклеофильного замещения,
3) нуклеофильного присоединения.
11. Реакция CH3–CH=CH2 + Cl2 → CH3–CHCl–CH2Cl относится к типу реакций…
1) электрофильного присоединения,
2) нуклеофильного присоединения,
3) электрофильного отщепления.
Ключи к тестовым заданиям
| № вопроса | |||||||||||
| № ответа |
Лабораторная работа № 13
Химические свойства органических соединений некоторых классов
Цель работы: изучение химические свойства некоторых органических соединений.
Реактивы: растворы K2Cr2O7, FeCl3, CuSO4, Na2CO3, NaCl, NaOH; H2SO4 (конц.); C6H5OH (р-р), HCOH (р-р), C2H5OH (96%), CH3COOH (конц.), NaHCO3 (сода), мыло, изоамиловый спирт.
Оборудование: пробирки и штатив для них, горелка, держатель, микрошпатель, стеклянная палочка, стеклянные стаканы, водяная баня.
Ход работы
Опыт 1. Окисление спирта в альдегид
Налейте в пробирку 1-2 мл раствора K2Сr2О7, добавьте 5-6 капель H2SO4 (конц.) и прилейте 3-5 капель этилового спирта. Оранжевая окраска раствора изменится на зеленую – цвет ионов Сr3+. При этом спирт окисляется в альдегид, который обнаруживается по его характерному запаху. Напишите уравнение окисления спирта в альдегид.
Опыт 2. Реакция фенола с хлорным железом (качественная реакция на фенол)
Налейте в пробирку 1-2 мл раствора фенола, добавьте 1-2 капли раствора FeCl3. Происходит образование фенолята железа, который окрашивает раствор в фиолетовый цвет. Напишите уравнение реакции.
Опыт 3. Восстановительные свойства альдегидов
Налейте в пробирку 1 мл формалина, прилить 4-5 мл раствора NaOH. Взболтайте содержимое пробирки. Прилейте по каплям раствор CuSO4 до появления осадка Сu(ОН)2. Затем нагрейте пробирку на горелке и наблюдать образование красного осадка закиси меди Сu2О. Напишите уравнение окисления формальдегида в муравьиную кислоту.
Опыт 4. Реакция уксусной кислоты с содой
Налейте в пробирку соды и прилейте уксусную кислоту. Какая протекает реакция, какой газ выделяется? Напишите уравнение реакции.
Опыт 5. Получение карбоновых кислот из мыла
В пробирку налейте наполовину воды и внесите несколько стружек мыла. Для ускорения растворения мыла пробирку нагрейте. К полученному раствору прилейте 1-2 мл раствора H2SO4 и нагрейте пробирку до кипения. В результате реакции на поверхности появляется слой органических кислот, которые после охлаждения затвердевают. Напишите уравнение реакции мыла (C17H35COONa) c H2SO4.
Опыт 6. Получение уксусно-изоамилового эфира
Налейте в пробирку по 2 мл конц. уксусной кислоты, изоамилового спирта и H2SO4 (конц.). Поместите пробирку на несколько минут в водяную баню. Вылейте содержимое пробирки в стакан с раствором NaCl. Ввиду малой растворимости эфира, он всплывает на поверхность. Напишите уравнение реакции.
Глава 14. ПОЛИМЕРЫ
После усвоения материала Главы 14 студент должен:
Знать
• определение полимеров, их классификацию;
• определение полимеризации, механизм радикальной и ионной полимеризации;
• суть процесса поликонденсации;
• различия кристаллических и аморфных полимеров;
• физические и химические свойства синтетических полимеров, их применение;
Уметь
• составлять реакции получения полимеров;
• рассчитать коэффициент полимеризаци;
• решать расчетные задачи по полимерам;
• экспериментально получать некоторые полимеры (плексиглас, новолачную и резольную смолы);
Владеть
• представлениями о строении и способах получения полимеров;
• навыками экспериментального получения некоторых полимеров (плексиглас, новолачная и резольная смолы);
• навыками составления реакций получения полимеров;
• навыками решения расчетные задач по полимерам
Природные полимеры
К природным полимерам, например, относят натуральный каучук, углеводы (крахмал, целлюлозу), белки.
Натуральный каучук
Натуральный каучук получают из млечного сока гевеи, произрастающей в Бразилии. Млечный сок, выделяющийся из надрезов на деревьях, представляет собой коллоидный раствор каучука. Его собирают и подвергают коагуляции действием раствора кислоты или нагреванием. Важнейшими свойствами каучука являются высокая эластичность, газо- и водонепроницаемость.
По химическому составу каучук относится к углеводородам, т.к. в его состав входят только углерод и водород. Термическим разложением каучука установлено, что макромолекулы его состоят из молекул изопрена: СН2=С(СН3)–СН=СН2.
Схематично образование полимера можно представить как последовательное присоединение мономеров:
СН2=С(СН3)–СН=СН2 + СН2=С(СН3)–СН=СН2 →
→ –СН2–С(СН3)=СН–СН2–С(СН3)=СН–СН2–
При этом свободные электроны средних атомов углерода образуют двойные связи в середине звеньев растущей цепи.
Строение макромолекулы каучука выражается формулой:
[–СН2–С(СН3)=СН–СН2–]n.
Макромолекулы имеют линейную структуру, но при этом они свернуты в клубки. При растяжении такие молекулы распрямляются, а образец каучука удлиняется. При снятии нагрузки молекулы возвращаются в прежнее состояние в результате внутреннего теплового движения. Размеры каучука сокращаются.
Натуральный каучук, преимущественно используется в виде резины. Для получения резины каучук подвергают вулканизации с серой и другими добавками. При нагревании атомы серы «сшивают» соседние линейные молекулы каучука по месту некоторых двойных связей. Образуется пространственная структура, обеспечивающая резине более высокую химическую стойкость, стойкость к истиранию, высокие электроизоляционные свойства, более высокую, чем у каучука газо- и водонепроницаемость. Резина не растворяется в бензине как каучук, а только набухает.
При вулканизации каучука с большим количеством серы степень «сшивания» повышается, материал утрачивает эластичность, становится твердым и превращается в эбонит.
Крахмал
Крахмал представляет собой порошок белого цвета, нерастворимый в воде. Он является продуктом фотосинтеза у зеленых растений. Состав крахмала выражается формулой: (С6Н10О5)n, где n может варьироваться от нескольких сотен до нескольких тысяч. Наряду с линейными молекулами имеются молекулы разветвленной структуры.
В кислой среде при нагревании с водой молекулы крахмала подвергаются гидролизу. Сначала при расщеплении молекул крахмала образуются промежуточные продукты – декстрины, затем мальтоза – изомер сахарозы, конечный продукт – глюкоза:
(С6Н10О5)n + nН2О → nС6Н12О6.
Установлено, что макромолекулы крахмала состоят из остатков молекул циклической α-глюкозы.
Крахмал является основным углеводом нашей пищи. В организме он подвергается ферментативному гидролизу. Образующаяся глюкоза поступает в кровь и идет на питание клеток организма. Избыток глюкозы депонируется печенью в виде гликогена, который имеет более разветвленную структуру. Он может превращаться в глюкозу по мере ее расходования.
Промежуточный продукт гидролиза – декстрины образуются в виде корки, при варке и жарке картофеля, выпечке хлеба, при глажении накрахмаленной ткани. Смесь декстринов и глюкозы – патока применяется в кондитерской промышленности для приготовления конфет, мармелада, пряников.
Крахмал злаков и картофеля идет на производство спирта. При этом его сначала подвергают гидролизу под действием фермента, содержащегося в солоде, а затем сбраживают в присутствии дрожжей.
Целлюлоза
Целлюлоза входит в состав растений, образуя оболочки клеток, придавая им прочность и эластичность. Волокна хлопка, льна, конопли представляют собой почти чистую целлюлозу. Из целлюлозы производят хлопчатобумажные ткани, бумагу. В чистом виде целлюлоза – твердое волокнистое вещество, не растворяющееся в воде и других растворителях.
Целлюлоза является природным полимером, молекулы которого состоят из остатков молекул β-глюкозы. Значение n у целлюлозы выше, чем у крахмала. Молекулы целлюлозы имеют только линейную структуру.
При нагревании без доступа воздуха целлюлоза разлагается с образованием воды, древесного угля, метилового спирта, уксусной кислоты, ацетона.
Целлюлоза подвергается гидролизу с образованием глюкозы. Суммарно гидролиз целлюлозы выражается тем же уравнением, что и гидролиз крахмала. Из этой глюкозы получают технический (гидролизный) спирт.
Каждое структурное звено молекулы целлюлозы содержит по три гидроксильных группы [C6H7O2(OH)3]n. За счет этих групп целлюлоза может образовывать простые и сложные эфиры. Так в реакции с азотной кислотой в присутствии серной кислоты образуются нитраты целлюлозы, которые обладают чрезвычайной горючестью.
[C6H7O2(OH)3]n + 3nHNO3 → [C6H7O2(ONO2)3]n + 3nH2O.
Тринитрат целлюлозы – пироксилин – взрывчатое вещество, применяется для производства бездымного пороха.
Уксуснокислые эфиры целлюлозы – диацетат и триацетат используют для приготовления искусственного ацетатного волокна. Для этого целлюлозу, выделенную из древесины или хлопковый пух обрабатывают уксусным ангидридом в присутствии серной кислоты. Продукт этерификации – триацетат целлюлозу растворяют в смеси дихлорметана CH2Cl2 и этилового спирта. Раствор полимера продавливают через фильеры, представляющие собой металлические колпачки с многочисленными отверстиями. Струи раствора опускаются в шахту высотой 3 м, продуваемую нагретым воздухом. Растворитель испаряется, а триацетат целлюлозы образует волокна, которые затем скручивают в нити. При прохождении через отверстия фильеров молекулы ацетата целлюлозы ориентируются вдоль струи раствора, их расположение становится упорядоченным. Это приводит к большой прочности волокон и нитей. Ткани из этого волокна обладают мягкостью, блеском, мало мнутся, хорошо сохраняют тепло, мало садятся при стирке.
Белки
Белки – природные высокомолекулярные азотсодержащие вещества. Молекулярная масса белков выражается десятками и сотнями тысяч, а иногда достигает нескольких миллионов. Они выполняют в организме множество функций. Это пластический материал, из которого построены ткани организма. Белки переносят вещества в организме, например, кислород, углекислый газ. Белки-ферменты катализируют все химические процессы в организме. Белки-антитела защищают организм от инфекций. Образование из белков актина и миозина актомиозина обусловливает сокращение мышечной ткани и т.д.
Гидролизом белков установлено, что они состоят из 20 α-аминокислот. Строение аминокислот, образующих белки, можно представить общей структурной формулой:
R–CH–COOH
│
NH2
В составе радикала могут быть углеводородные цепи, циклы, различные функциональные группы (–SH, –OH, –COOH, –NH2, бензольное кольцо).
Молекулы белка представляют собой длинные цепи остатков аминокислот, соединенных пептидными связями. Группа атомов:
( –С – N – ) – пептидная группа.
║ │
O H
Пептидные связи образуются при взаимодействии карбоксильной группы одной кислоты с аминогруппой другой. Поэтому белки называют еще полипептидами.
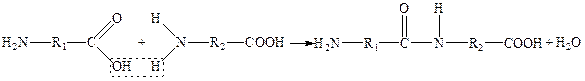
Последовательность чередования различных аминокислотных звеньев в полипептидной цепи называется первичной структурой белковой молекулы.
Полипептидные цепи на значительной своей части свернуты в виде спирали. Эта конфигурация полипептидной цепи называется вторичной структурой белка. Она удерживается за счет многочисленных водородных связей, образованных между группами >С=О и >NH, расположенными на соседних витках спирали.
Третичная структура – это конфигурация, которую принимает в пространстве спираль полипептидной цепи. Ее часто называют глобулой белка. Эта структура поддерживается взаимодействием функциональных групп радикалов аминокислот, составляющих полипептидную цепь. Солевые мостики образуются при сближении карбоксильной и аминогруппы, дисульфидные мостики (–S–S–) образуются между радикалами двух молекул цистеина, сложноэфирные мостики образуются между карбоксильной группой и гидроксилом и т.д. Функциональные группы аминокислот, обращенные наружу глобулы белка, определяют ее специфическую биологическую активность.
Иногда несколько глобул объединяются в более сложную структуру, которую называют четвертичной структурой белка.
Под действием различных факторов, таких как нагревание, действие радиации, сильное встряхивание третичная и вторичная структура белков может разрушаться. Этот процесс называется денатурацией. Денатурированный белок утрачивает биологическую активность.
Существуют белки, молекулы которых не скручиваются в спираль, а имеют вытянутую форму. Такую структуру имеют молекулы белка фибрина, входящего в состав натурального шелка.
Дата добавления: 2017-11-21; просмотров: 1259;











