Электронное стоение и положение в периодической системе
Металлы d-семейства расположены в больших периодах периодической системы элементов Д.И. Менделеева между s- и р-элементами, образуя побочные группы. Их называют также переходными металлами.
Они имеют валентную электронную структуру, выражающуюся общей формулой: (n–l)d1-10ns1-2. В периоде у d-элементов постепенно заполняется d-подуровень предвнешнего энергетического уровня, при этом на внешнем уровне находится 1-2 s-электрона. Такое заполнение энергетических уровней атомов определяет их общие свойства.
Таблица 11.1
Электронные кофигурации валентных уровней d-металлов IV периода
| Металл | Валентные электроны | Проявляемая валентность |
| Sc | 3d14s2 | |
| Ti | 3d24s2 | 2, 3, 4 |
| V | 3d34s2 | 2, 3, 4, 5 |
| Cr | 3d54s1(проматирование) | 2, 3, 4, (5), 6 |
| Mn | 3d54s2 | 2, 3, 4, (5), 6, 7 |
| Fe | 3d64s2 | 2, 3, (6) |
| Co | 3d74s2 | 2, 3, (4) |
| Ni | 3d84s2 | 2, 3 |
| Cu | 3d104s1 (проматирование) | 1, 2, (3) |
| Zn | 3d104s2 |
Из данных, приведенных в таблице 11.1 видно, что высшая валентность, проявляемая элементами IV периода, сначала увеличивается от трех у скандия до семи у марганца, затем уменьшается до двух у цинка. Это объясняется тем, что количество неспаренных электронов d-подуровня сначала увеличивается от элемента к элементу, а затем уменьшается.
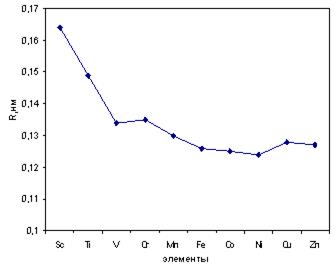
Рис. 11.1. Радиусы атомов d-элементов IV периода
Радиусы атомов d-элементов в периоде уменьшаются, но не монотонно, имеется два пика у хрома и меди (рис. 11.1). Это связано с явлением промотирования (провала) электрона в d-состояние предвнешнего уровня. При этом каждая орбиталь d-подуровня содержит по одному электрону. Такая конфигурация подуровня является устойчивой (энергетически выгодной). На внешнем уровне остается только один электрон, притяжение к ядру ослабевает, что ведет к увеличению радиуса атома.
В Б-группах у элементов (рис. 11.2), стоящих после лантаноидов не наблюдается увеличения радиуса атома, как у элементов А-групп. Это связано с лантаноидным сжатием. У элементов семейства лантана увеличивается число электронов на предпредвнешнем, более близком к ядру энергетическом уровне, это усиливает притяжение электронов этого уровня к ядру и вызывает уменьшение радиуса атома, ведущее к ослаблению металлических свойств у элементов, стоящих после лантаноидов.
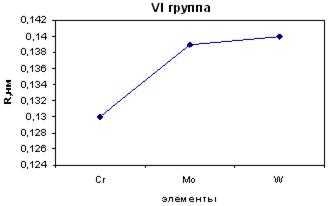
Рис. 11.2. Радиусы атомов элементоа IVБ группы.
Энергия ионизации d-металлов четвертого периода (рис. 11.3) возрастает с увеличением порядкового номера, причем особенно резко у марганца и цинка, имеющих наполовину (3d54s2) или полностью (3d104s2) заполненные электронами подуровни, что говорит об их устойчивости.
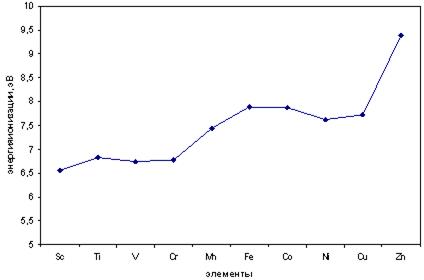
Рис. 11.3. Энергия ионизации d-элементов IV периода
Дата добавления: 2017-11-21; просмотров: 1122;











