Поляризация и перенапряжение
При наложении электрического тока от внешнего источника потенциалы электродов смещаются: катода - в отрицательную, анода - в положительную стороны. Электроны по внешней цепи перетекают быстрее, чем происходят электродные реакции.В результате на катоде электроны накапливаются, а на аноде накапливаются положительные заряды. Изменение потенциала от равновесного при протекании внешнего тока называется электрохимической поляризацией электродов:
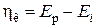 (катодная поляризация), (катодная поляризация),
| (9.10) | |
 (анодная поляризация). (анодная поляризация).
| (9.11) |
Электродная поляризация – функция плотности тока, чем выше плотность – тем больше поляризация.
Электродный процесс под током – гетерогенная реакция, состоящая из стадий:
1. Транспорт реагирующих веществ из объема раствора к поверхности электрода и обратный транспорт продуктов.
2. Электрохимическая реакция – переход электронов и ионов через границу раздела раствор – металл (разряд, ионизация).
3. Фазовые превращения. Образование или разрушение кристаллической решетки, формирование и выделение газов.
4. Химические реакции, предшествующие или последующие электрохимической стадии.
Первая и вторая стадии присущи всем электродным процессам, остальные – отдельным процессам.
Скорость электродного процесса определяется скоростью наиболее медленной стадии, которая называется лимитирующей. Если природа лимитирующей стадии известна, то вместо «поляризация» употребляют термин «перенапряжение»: перенапряжение диффузии (hд), перенапряжение электронного перехода или электрохимическое перенапряжение (hэ), перенапряжение фазового перехода (hф), перенапряжение реакции (hр).
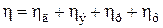 . .
| (9.12) |
Хотя в каждом конкретном случае определяющим может быть один вид перенапряжения.
Перенапряжение выделения водорода. При электролизе водных электролитов часто выделяется водород.
а) в кислой среде: 2Н+ +2ē → Н2;
б) в нейтральной и щелочной: 2Н2О +2ē → Н2 + 2ОН–.
Выделение водорода сопровождается значительным перенапряжением, зависящим от природы электрода. На металлах перенапряжение водорода убывает в последовательности: Hg – Pb – Zn – Al – Sn – Cu.
Для осуществления электролиза к электролизеру необходимо приложить рабочее напряжение:
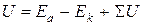 , ,
| (9.13) |
где Еа и Ек – потенциалы анода и катода при рабочей плотности тока; SU – падение напряжения на преодоление омического сопротивления цепи (контактов, раствора, электродов); 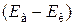 – напряжение разложения электролита, которое в свою очередь равно сумме обратимого напряжения разложения и перенапряжения на электродах:
– напряжение разложения электролита, которое в свою очередь равно сумме обратимого напряжения разложения и перенапряжения на электродах:
 , ,
| (9.14) |
где 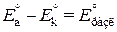 – обратимое напряжение разложения электролита, численно равное ЭДС реакции, которое можно рассчитать по термодинамическим данным:
– обратимое напряжение разложения электролита, численно равное ЭДС реакции, которое можно рассчитать по термодинамическим данным:  ;
; 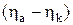 – перенапряжение на электродах.
– перенапряжение на электродах.
Дата добавления: 2017-11-21; просмотров: 2337;











