УРАВНЕНИЕ КЛАПЕЙРОНА - КЛАУЗИУСА
Вещество в зависимости от температуры и давления может находиться в твердой, жидкой и газообразной фазе.
Фазовым переходом называется процесс, сопровождающийся затратой теплоты и изменением объема, в котором происходит изменение агрегатного состояния вещества. Переход из одного агрегатного состояния в другое удобно рассматривать на рТ – диаграмме (рис.6.1)
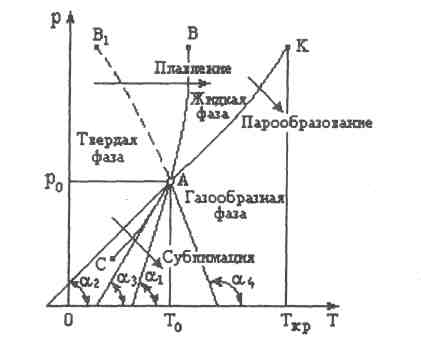
Рис. 6.1
Если в качестве независимого параметра взять температуру, то на рТ - диаграмме будут иметь место три характерные линии
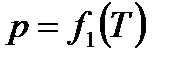 ;
; 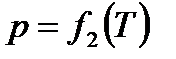 ;
; 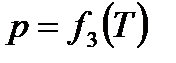 ;
;
Эти линии представляют собой геометрическое место точек, в которых находится в равновесном состоянии любая пара из трех агрегатных состояний вещества.
Линия 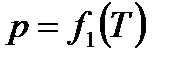 (линия АК на рис.6.1.) соответствует равновесному состоянию жидкой и газообразной (парообразной) фаз. Эту линию еще называют линией испарения (или по обратному процессу - линией конденсации).
(линия АК на рис.6.1.) соответствует равновесному состоянию жидкой и газообразной (парообразной) фаз. Эту линию еще называют линией испарения (или по обратному процессу - линией конденсации).
Линия 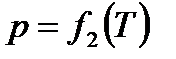 (линия АС) соответствует равновесному состоянию твердой и газообразной фаз. Это линия сублимации (или по обратному процессу - десублимации).
(линия АС) соответствует равновесному состоянию твердой и газообразной фаз. Это линия сублимации (или по обратному процессу - десублимации).
На линии 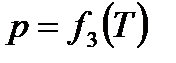 (линия A В) находятся в равновесии твердая и жидкая фазы. Эта линия называется линией плавления (или по обратному процессу - затвердевания).
(линия A В) находятся в равновесии твердая и жидкая фазы. Эта линия называется линией плавления (или по обратному процессу - затвердевания).
Переход из одного агрегатного состояния в другое при данной температуре будет происходить при строго определенных давлениях или при данном давлении при строго определенных температурах. Если, например, какое-либо вещество превращается из жидкого состояния в парообразное при определенном давлении, то его температура будет неизменной до тех пор, пока вся жидкость не превратиться в пар. Аналогичные процессы будут происходить и на линиях плавления и сублимации.
Температура, при которой происходит переход вещества из твердого состояния в жидкое, называется температурой плавления (затвердевания). Количество теплоты, отбираемое в этом процессе, называется теплотой плавления (при затвердевании эта же теплота будет выделяться).
Температура перехода вещества из жидкого состояния в газообразное называется температурой кипения (при данном давлении) или - температурой конденсации в обратном процессе. Количество теплоты, поглощаемое в этом процессе, называется теплотой парообразования (при конденсации это же количество теплоты будет выделяться).
Температура перехода вещества из твердого состояния в газообразное называется температурой сублимации, а количество теплоты, подведенной в этом процессе, называется теплотой сублимации. Обратный переход - десублимация будет сопровождаться выделением этого же количества теплоты.
Кривая, на которой в зависимости от температуры и давления происходит переход из жидкого состояния в газообразное, заканчивается в точке К, называемой критической точкой. В этой точке исчезает физическое различие между жидким и газообразным состоянием вещества. Обоснование наличия критической точки наиболее наглядно можно проследить на pV - диаграмме водяного пара (рис.6.2.).
Увеличение давления приводит к увеличению температуры кипения. При этом объем V газообразной фазы уменьшается, а объем жидкой фазы V возрастает. При некотором давлении (р=ркр=22,12 МПа - для воды) эти два объема оказываются одинаковыми, что и наблюдается в критической точке, которой соответствует определенная для каждого вещества критическая температура (для воды tкр = 374,16 °С, см. § 6.3 ). Следовательно, в критической точке сухой пар имеет такую же плотность, что и кипящая вода и, таким образом, исчезает различие между жидкой и паровой фазами.
Все три кривые равновесного состояния различных фаз вещества пересекаются в некоторой определенной для каждого вещества точке, называемой тройной точкой (точка А на рис.6.1.). В этой точке в термодинамическом равновесии находятся три различные фазы вещества - твердая, жидкая и газообразная, т.е. пропадает различие между этими тремя фазами.
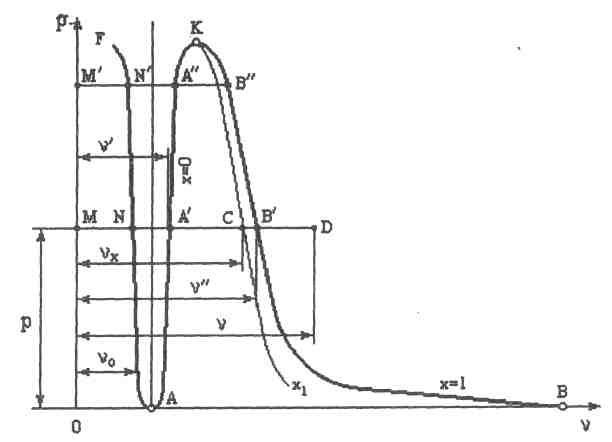
Рис. 6.2
Отметим некоторые особенности фазовых переходов.
Теплоемкость ср в процессе фазового перехода равна бесконечности
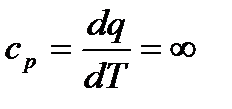 ,
,
так как 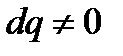 ,
, 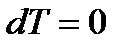
Коэффициенты изобарного (объемного) расширения α (2.12) и изотермического сжатия 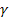 равны бесконечности
равны бесконечности
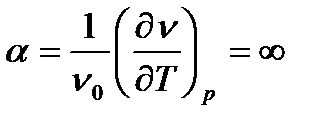 ;
; 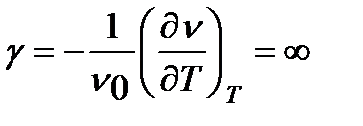 ,
,
так как 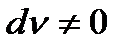 ;
; 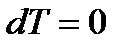 ;
; 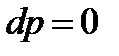 .
.
Значительный интерес представляет уравнение Клапейрона-Клаузиуса, связывающее термические величины (температура, давление, удельный объем) с калорическими (теплота фазового перехода). Это уравнение имеет вид (вывод см. в [13])
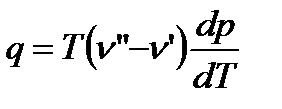 ,
,
где q - теплота фазового перехода; 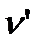 - удельный объем жидкости или твердого тела;
- удельный объем жидкости или твердого тела; 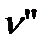 - удельный объем пара; dp/dT - производная от давления по температуре, взятая на кривой фазового перехода.
- удельный объем пара; dp/dT - производная от давления по температуре, взятая на кривой фазового перехода.
Уравнение Клайперона - Клаузиуса может быть применено ко всем изменениям агрегатного состояния веществ. В общем виде оно характеризует изменение давления фаз, находящихся в равновесии, от температуры. Но физический смысл входящих в это уравнение величии в каждом отдельном случае различен.
В случае плавления твердого тела (кривая АВ на рис. 6.1) величины из уравнения Клайперона-Клаузиуса будут иметь следующий физический смысл: q - удельная теплота плавления; 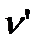 - удельный объем твердого тела;
- удельный объем твердого тела; 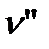 - удельный объем жидкости. В случае газообразования (кривая АК): q - удельная теплота парообразования;
- удельный объем жидкости. В случае газообразования (кривая АК): q - удельная теплота парообразования; 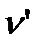 - удельный объем кипящей жидкости;
- удельный объем кипящей жидкости;
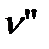 - удельный объем сухого насыщенного пара.
- удельный объем сухого насыщенного пара.
При сублимации (кривая
AC): q - удельная теплота сублимации; 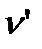 - удельный объем твердого тела;
- удельный объем твердого тела; 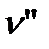 - удельный объем сухого насыщенного пара.
- удельный объем сухого насыщенного пара.
С помощью уравнения Клапейрона - Клаузиуса можно установить наклон линий плавления, испарения и сублимации в тройной точке. Запишем это уравнение в виде
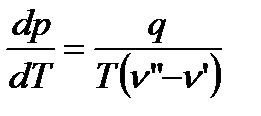 .
.
Так как величины q, T, 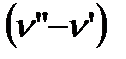 для всех веществ всегда положительны (за исключением воды ввиду ее аномальности), то
для всех веществ всегда положительны (за исключением воды ввиду ее аномальности), то
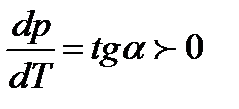 .
.
Отсюда следует, что утлы наклона α1, а2, а3 касательных кривых АВ, АК и АС в точке А к оси Т будут меньше 90° (рис.6.1).
Для воды вследствие ее аномальности объем воды в момент фазового перехода меньше объема льда 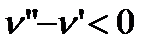 . Поэтому величина dp/dT из уравнения Клайперона - Клаузиуса будет отрицательной и следовательно угол наклона α4 кривой плавления льда (кривая АВ1) будет больше 90°.
. Поэтому величина dp/dT из уравнения Клайперона - Клаузиуса будет отрицательной и следовательно угол наклона α4 кривой плавления льда (кривая АВ1) будет больше 90°.
Таким образом, для всех нормальных жидкостей 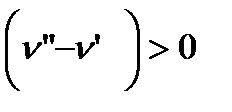 и все линии фазовых превращений отклоняются вправо. Для воды кривая AB1 равновесного состояния твердой и жидкой фаз с повышением давления отклоняется в сторону меньших температур (влево).
и все линии фазовых превращений отклоняются вправо. Для воды кривая AB1 равновесного состояния твердой и жидкой фаз с повышением давления отклоняется в сторону меньших температур (влево).
§ 6.3. pν- ДИАГРАММА ВОДЯНОГО ПАРА
На рис. 6.2. представлена фазовая pν - диаграмма, которая представляет собой график зависимости удельного объема воды и водяного пара от давления (см.§ 2.5).
Кривая AF представляет зависимость удельного объема воды от давления при температуре
t = 0° С, т.е. это есть изотерма воды при нулевой температуре. Область, заключенная между этой изотермой и осью ординат, является областью равновесного сосуществования жидкой и твердой фаз. Кривая AF почти параллельна оси ординат, так как вода практически несжимаемая жидкость. Поэтому удельный объем 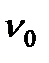 воды в процессе сжатия изменяется незначительно.
воды в процессе сжатия изменяется незначительно.
При нагреве воды при некотором постоянном давлении p удельный объем будет увеличиваться и при достижении температуры кипения в точке А' удельный объем 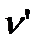 жидкости становится максимальным. С увеличением давления температура кипения возрастает и удельный объем
жидкости становится максимальным. С увеличением давления температура кипения возрастает и удельный объем 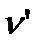 в точке А" будет больше, чем в точке А'.
в точке А" будет больше, чем в точке А'.
Зависимость удельного объема 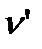 от давления на pv - диаграмме изображается кривой АК, называемой пограничной кривой жидкости. Всюду на этой кривой степень сухости х=0.
от давления на pv - диаграмме изображается кривой АК, называемой пограничной кривой жидкости. Всюду на этой кривой степень сухости х=0.
Дальнейший подвод к жидкости теплоты при неизменном давлении приводит к процессу парообразования (линия А' В'), который заканчивается в точке В'. Пар в этой точке будет сухим насыщенным с удельным объемом 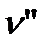 Процесс А'В' является одновременно изобарным и изотермическим.
Процесс А'В' является одновременно изобарным и изотермическим.
Зависимость удельного объема 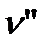 от давления представлена кривой KB, которая называется пограничной кривой пара. На этой кривой степень сухости х=1.
от давления представлена кривой KB, которая называется пограничной кривой пара. На этой кривой степень сухости х=1.
Если в состоянии, характеризуемом точкой В' (или В" при большем давлении), к пару подводить теплоту, то его температура и удельный объем будут увеличиваться. Линия В'Д представляет процесс перегрева пара.
Таким образом, кривые АК и KB делят область диаграммы на три части. Левее кривой АК расположена область жидкости. Между кривыми АК и KB расположена область двухфазной системы, включающей пар и жидкость (пароводяная смесь). Правее кривой KB и выше точки К расположена область перегретого пара.
Точка К называется критической точкой (см. §2.5 и §6.2). Параметры критической точки для воды: tк= 374,160 С; 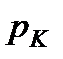 = 22,12 МПа;
= 22,12 МПа; 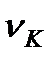 = 0,0032 м3/кг; iк= 2095,2 кДж/(кг.К).
= 0,0032 м3/кг; iк= 2095,2 кДж/(кг.К).
Точка А характеризует состояние кипящей жидкости в тройной точке (см. § 6.2). Температура кипения воды в этой точке t0 = 0,001°С ≈ 0°С. Если в состоянии, характеризуемом тройной точкой, к жидкости подводить теплоту, то процесс кипения будет происходить по изобаре являющейся одновременно нулевой изотермой, которая при выбранном масштабе изображения кривых практически совпадает с осью абсцисс.
Между кривыми х=0и х=1расположены кривые промежуточных степеней сухости. Все они исходят из точки К.Одна из таких кривых со степенью сухости 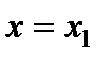 приведена на рис. 6.2.
приведена на рис. 6.2.
Удельное количество работы 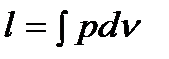 , полученной в процессе или цикле, на pv - диаграмме изображается соответствующей площадью под кривой процесса или внутри цикла (см. рис. 6,7а, 6,8а, 6,9а).
, полученной в процессе или цикле, на pv - диаграмме изображается соответствующей площадью под кривой процесса или внутри цикла (см. рис. 6,7а, 6,8а, 6,9а).
§ 6.4. Ts - ДИАГРАММА ВОДЯНОГО ПАРА
Процесс нагрева воды от 0,01°С = 273,16 К до температуры кипения при давлении p1-const характеризуется линией АаA1. Линия А1В1является процессом парообразования и линия В1Д1- процессом перегрева пара (рис. 6.3.). Если нанести на Ts - диаграмме ряд таких изобарных процессов и соединить точки, в которых начинается и заканчивается процесс кипения, то получим две пограничные кривые АК - кривая начала кипения (х=0) и KB - кривая окончания кипения (кривая сухого пара x=1), которые сходятся в критической точке К.
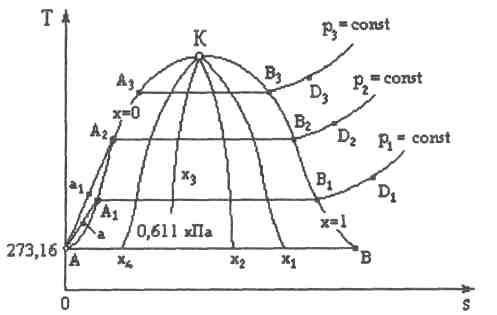
Рис. 6.3
Точка А здесь является тройной точкой (см. § 6.2,6.3) которой соответствует изобара
Р0=0,611кПа и изотерма t0=0,01° С =273,16 К.
Пограничные кривые АК и KB делят область диаграммы на три части. Левее кривой АК расположена область жидкости. Между кривыми АК и ВК -область влажного пара (пароводяной смеси). Правее кривой KB и выше точки К находится область перегретого пара. Кривая АК берет свое начало в тройной точке А, расположенной на оси ординат, т.е. считается, что удельная энтропия при температуре 273,16°С близка к нулю. Изобары нагрева воды АаА1, Аа1А2до температуры кипения соответственно при давлениях р1и р2даны как для нормальной жидкости, т.е. без учета аномальности воды, имеющей максимальную плотность при температуре t =4° С. Это допущение незначительно влияет на точность при расчетах. Давлению в тройной точке
р = 0,611кПа соответствует изобара АВ.
Между кривыми АК и KB нанесены кривые промежуточных степеней сухости х1, x2, xз, x4, все эти кривые сходятся в критической точке К,где исчезает различие между жидкой и паровой фазами, т.е. сухой пар и кипящая вода имеют одинаковую плотность.
Удельное количество теплоты 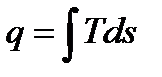 , сообщаемое рабочему телу, на Ts - диаграмме изображается площадью под кривой процесса (см. рис. 6.6б, 6.7б, 6.8б). Удельная работа обратимого цикла l = q1-q2также может быть найдена в виде площади цикла. Таким образом, с помощью Ts - диаграммы достаточно просто можно найти термический кпд
, сообщаемое рабочему телу, на Ts - диаграмме изображается площадью под кривой процесса (см. рис. 6.6б, 6.7б, 6.8б). Удельная работа обратимого цикла l = q1-q2также может быть найдена в виде площади цикла. Таким образом, с помощью Ts - диаграммы достаточно просто можно найти термический кпд 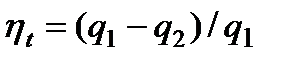 обратимого цикла.
обратимого цикла.
Удобство Ts - диаграммы в том, что она позволяет проследить изменение температуры рабочего тела и находить количество теплоты, участвующее в процессе. К неудобствам диаграммы следует отнести необходимость измерения соответствующих площадей. Ts - диаграмма широко применяется при исследовании паросиловых и холодильных установок, обеспечивая наиболее наглядное изображение процессов.
§6.5. iS - ДИАГРАММА ВОДЯНОГО ПАРА
is - диаграмма является наиболее удобной для расчетных целей. Это связано с тем, что удельные количества теплоты и работы изображаются не площадями, как это имеет место в Ts- и pv - диаграммах, а отрезками линий (рис.6.4).
За начало координат в is - диаграмме принято состояние воды в тройной точке, где s0=0 (допущение) io=0. По оси абсцисс откладывается удельная энтропия, а по оси ординат - удельная энтальпия. На основе данных таблиц водяного пара на диаграмму наносятся пограничные кривые жидкости (АК) и пара (KB) (соответственно нулевой х=0и единичной х=1степени сухости), сходящиеся в критической точке К. Пограничная кривая жидкости выходит из начала координат.
Изобары (p=const)в области влажного пара являются прямыми наклонными линиями, берущими начало на пограничной кривой нулевой степени сухости, к которой они касательны. В этой области изобары и изотермы совпадают, т.е. они имеют одинаковый коэффициент наклона к оси абсцисс. Для любой изобары - изотермы
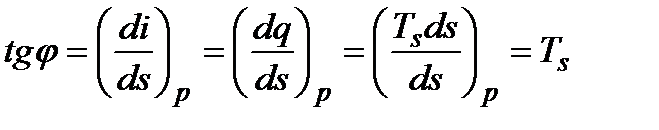 ,
,
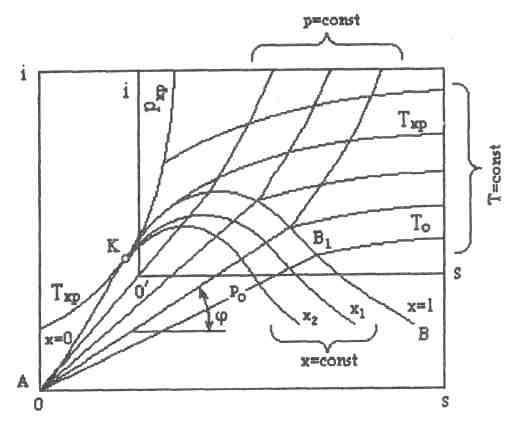
Рис. 6.4
где φ- угол наклона изобар к оси s, Ts - температура насыщения, неизменная для данного давления всюду между пограничными кривыми AК и КВ.
В области перегретого пара (правее и выше кривой х=1) изобары имеют вид кривых отклоняющихся вверх с выпуклостью, направленной вниз. Изотермы в этой области отклоняются вправо и их выпуклость направлена вверх. Изобара АВ1соответствует давлению в тройной точке р0=0,000611 МПа. Область диаграммы, расположенная ниже тройной точки, характеризует различные состояния смеси пара и льда.
Между кривыми АК и KB наносится сетка линий постоянной степени сухости (x=const)пара, сходящихся в критической точке К.
Кроме того, на диаграмму наносится сетка изохор, имеющих вид кривых, поднимающихся вверх (как в области влажного, так и в области перегретого пара) более круто, чем изобары. На is -диаграмме рис. 6.3. изохоры не приведены.
В практических расчетах обычно используется лишь область диаграммы, расположенная в правом верхнем углу. В связи с чем, начало координат переносится из точки 0 в точку 0', что дает возможность изображать диаграмму в большем масштабе.
Диаграмма is широко применяется для расчета процессов с водяным паром. Общий метод состоит в следующем.
1. По заданным начальным параметрам, характеристике процесса и заданному конечному параметру в is-диаграмме находится график процесса.
2. По начальной и конечной точкам процесса находятся все основные параметры пара в этих точках.
3.Определяется изменение внутренней энергии по формуле
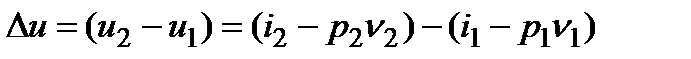 .
.
4.Определяется теплота процесса по формулам:
а) процесс ν = const 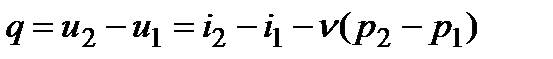 ;
;
б) процесс р = const 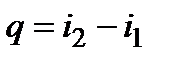 ;
;
в) процесс Т = const 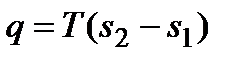 ;
;
г) процесс s = const q = 0.
5.0пределяется удельная работа по формуле
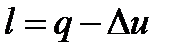 .
.
Все рассмотренные выше диаграммы в pv-, Ts- и is- координатах в соответствующих масштабах строятся на основе таблиц параметров, полученных из опытных и теоретических данных. Наиболее точные таблицы для водяного пара разработаны в Московском энергетическом институте под руководством проф. М.П.Вукаловича [9, 16].
Дата добавления: 2016-06-05; просмотров: 4035;











