Первое начало термодинамики.
Внутренняя энергия может изменяться за счет в основном двух различных процессов: совершения над телом работы А' и сообщения ему количества тепла Q.
Совершение работы сопровождается перемещением внешних тел, воздействующих на систему. Так, например, при вдвигании поршня, закрывающего заключенный в сосуде газ, поршень, перемещаясь, совершает над газом работу А'. По третьему закону Ньютона газ при этом совершает над поршнем работу А = – А'.
Сообщение телу тепла не связано с перемещением внешних тел и, следовательно, не связано с совершением над телом макроскопической (т. е. относящейся ко всей совокупности молекул, из которых состоит тело) работы. В этом случае изменение внутренней энергии обусловлено тем, что отдельные молекулы более нагретого тела совершают работу над отдельными молекулами тела, нагретого меньше. Передача энергии происходит при этом также через излучение. Совокупность микроскопических (т. е. захватывающих не все тело, а отдельные его молекулы) процессов, приводящих к передаче энергии от тела к телу, носит название теплопередачи.
Подобно тому как количество энергии, переданное одним телом другому, определяется работой А, совершаемой друг над другом телами, количество энергии, переданное от тела к телу путем теплопередачи, определяется количеством тепла Q, отданного одним телом другому. Таким образом, приращение внутренней энергии системы должно быть равно сумме совершенной над системой работы А' и количества сообщенного системе тепла Q:
DU = Q + А',
где DU = U2 – U1 , а U1и U2 – начальное и конечное значения внутренней энергии системы. Обычно вместо работы А', совершаемой внешними телами над системой, рассматривают работу А (равную –А'), совершаемую системой над внешними телами. Подставив –А вместо А' и разрешив относительно Q, последнее уравнение можно привести к виду
Q = DU + А.
Данное уравнение выражает закон сохранения энергии и представляет собой содержание первого закона (начала) термодинамики. Словами его можно выразить следующим образом: количество тепла, сообщенное системе, идет на приращение внутренней энергии системы и на совершение системой работы над внешними телами.
Сказанное отнюдь не означает, что всегда при сообщении тепла внутренняя энергия системы возрастает.
Может случиться, что, несмотря на сообщение системе тепла, ее энергия не растет, а убывает (U2 < U1). В этом случае А > Q, т. е. система совершает работу как за счет получаемого тепла Q, так и за счет запаса внутренней энергии, убыль которой равна U1 – U2. Нужно также иметь в виду, что величины Q и А являются алгебраическими (Q < 0 означает, что система в действительности не получает тепло, а отдает).
Количество тепла Q измеряется в тех же единицах, что и работа или энергия. В СИ единицей количества тепла служит джоуль.
Теплоемкость.
При сообщении системе теплоты Q ее температура изменяется на 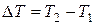 . Величина
. Величина
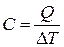
называется теплоемкостью. Теплоемкость измеряется количеством теплоты, затрачиваемым для повышения температуры тела на один кельвин.
Нагревая тела с одинаковыми массами, но состоящие из различных веществ, можно обнаружить, что для повышения их температуры на 1 К требуются различные количества теплоты; следовательно, теплоемкость тела зависит от его природы.
Теплоемкость зависит, очевидно, от массы тела. Теплоемкость, отнесенная к массе тела, называется удельной
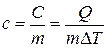 .
.
Зная теплоемкость вещества, можно определить количество теплоты, необходимое для нагревания тела массой m от температуры T1 до температуры T2:
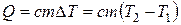 .
.
Теплоемкость зависит от условий, в которых телу сообщается теплота и изменяется его температура. Например, если газу сообщается количество теплоты DQ и при этом газ расширяется, совершая работу, то его температура поднимается меньше, чем если бы при сообщении теплоты DQ газ не расширился. Этот пример показывает, что выражение для теплоемкости не является определенным и может быть равным любому значению. Для придания теплоемкости определенного значения необходимо указать условия, о которых идет речь. Эти условия обозначаются в виде индексов у величин, входящих в выражение для теплоемкости.
Теплоемкость при постоянном объеме определяется как
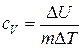 .
.
В термодинамике используется также теплоемкость при постоянном давлении, но выражение для нее приводить здесь не будем.
Дата добавления: 2021-09-25; просмотров: 600;











