Атипичный (Д-) ГУС, аГУС
Атипичный ГУС развивается в любом возрасте составляет 5-10% всех случаев ГУС у детей (возможно развитие, начиная с раннего возраста), и чаще, чем Д+ ГУС, встречается у взрослых.
Патогенез. В основном является следствием нарушения регуляции системы комплемента (табл. 8.1).
Таблица 8.1. Биологические исследования при аГУС (адаптировано по Ariceta G., Besbas N., Johnson S., Karpman D. et al.)
| Классификация | Биологические исследования |
| 1. Аномалии регуляции комплемента | СЗ и С4 плазмы CFH и CFI плазмы Анти-CFH антитела МСР (CD46) (экспрессия на поверхности лейкоцитов) Скрининг мутаций CFH, CFI, МСР, CFB и СЗ |
| 2. Дефицит ADAMTS 13 (наследственный или приобретенный) | Активность ADAMTS 13 плазмы; Если активность <10% от нормы, определить наличие ингибиторов и анти-ADAMTS 13 IgG; Если активность <10%, нет ингибиторов и анти- ADAMTS 13 IgG, возможен наследственный дефицит. Подтвердить с помощью исследования гена ADAMTS 13 |
| 3.Аномалии метаболизма кобаламина | Гомоцистеин, метилмалоновая кислота (плазма и моча) ± исследование гена ММАСНС |
Пусковым фактором могут явиться лекарственные препараты, такие как: хинин, ингибиторы калицинейрина, рапамицин, ципрофлоксацин, контрацептивные препараты, гепарин и др. Клинически ГУС и ТТП имеют много сходного. Поэтому обычно исследуют и исключают дефицит ADAMTS 13. У младенцев аГУС может развиться в результате аномалии внутриклеточного метаболизма кобаламина (витамин В12).
Развитие аГУС и ряда других заболеваний клубочков (например С3-гломерулопатии) связано с мутацией белков системы комплемента. Чаще всего встречается дефицит фактора Н (CFH), а также – мутация фактора I (CFI) и МСР. Эти три фактора, действуя сообща, в норме предотвращают активацию системы комплемента (рис. 8.1).
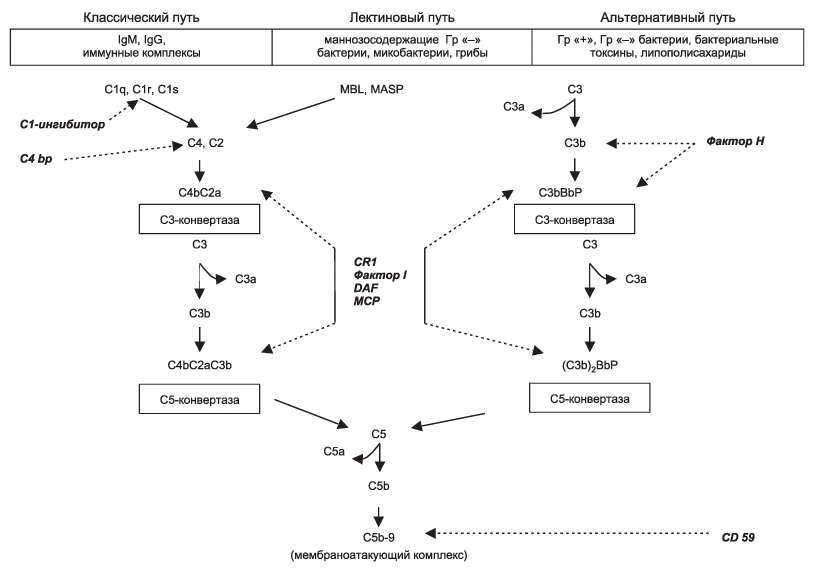
Рисунок 8.1. Система комплемента (С Байко. Нефрология и диализ. №4, 2007).
Система комплемента человека имеет сложно организованную систему регуляции, необходимую для предупреждения неспецифического повреждения клеток хозяина и ограничения отложения С3b на поверхности патогенов. Эта тонкая регуляция осуществляется благодаря целому ряду мембранных (CR1, DAF, MCP и CD59) и жидкофазных (фактор Н) факторов, защищающих ткани хозяина. Поверхности чужеродных клеток, лишенные мембранных регуляторов или не способные связывать растворимые регуляторы, атакуются комплементом.
Мутации генов, кодирующих их, приводят к утрате защиты эндотелиальных клеток. В результате увеличивается количество C3b, получающего доступ к поверхности эндотелиальных клеток. Отложение C3b на эндотелии ведет к образованию мембраноатакующего комплекса (С5b-9), который вызывает повреждение и отслойку клеток и сублитическое повреждение мембраны, в свою очередь ведущих к эндотелиальной активации и экспрессии молекул адгезии (например, Р-селектина). Последние способствуют адгезии и активации лейкоцитов с высвобождением радикалов кислорода и протеиназ, усугубляющих повреждение эндотелия. Повреждение эндотелия приводит к отслойке клеток и обнажению базальной мембраны. В этих условиях происходит адгезия тромбоцитов к обнаженному внеклеточному веществу и их агрегация с образованием микрососудистых тромбов.
Клиническая картина. Очень раннее (даже в период новорожденности) начало характерно для аГУС, связанного с мутациями CFН и CFI (средний возраст 6 месяцев и 2 месяца, соответственно). Мутация МСР более характерна для детей с началом заболевания после 1 года жизни. Ближе к подростковому возрасту определяются анти-CFH-антитела. Провоцирующими факторами могут быть инфекции верхних дыхательных путей, ЖКТ, которые запускают первый эпизод ГУС. Семейные случаи выявляются в 25% случаев. Не все носители мутации в семье имеют манифестацию заболевания.
Почечные и другие клинические проявления такие же, как при любом варианте ГУС, но прогноз хуже, чем при Д+ ГУС. У 50% пациентов развивается тХПН, возможны поражения других органов, в том числе ЦНС.
Лечение. Более благоприятен прогноз при мутации МСР. Плазмообмен позволяет удалить мутантные CFH, CFI, С3 и антитела. Для предотвращения повышения уровня антител после ЗПП обосновано применение ГКС и иммуносупрессивных препаратов. Недавно опубликованы рекомендации по плазмотерапии при аГУС (табл.8.2.)
Таблица 8.2.Рекомендации 2008-2009 гг. по плазмотерапии при аГУС
(Адаптировано по Ariceta G., Besbas N., Johnson S., Karpman D. et al.)
| Когда необходимо начать плазмотерапию? |
| • Как можно раньше (в течение 24 ч от начала) • Как только состояние пациента позволит (АД, гиперволемия, водно-солевой баланс, анемия) |
| Выбор варианта и объем? |
| • ЗПП: 1,5 объема плазмы (60-75 мл/кг) с замещением СЗП • Если проведение ЗПП невозможно, ввести СЗП 10—20 мл/кг (при нормальном АД и сердечной функции) |
| Какова частота в течение первого месяца? |
| • Ежедневно в течение 5 дней • 5 сеансов в неделю в течение 2-х недель • 3 сеанса в неделю в течение последующих 2-х недель |
| В каких случаях возможно отказаться от плазмотерапии или рано прекратить ее? |
| • Мутация МСР (ЗПП проводится во время активности ГУС, но не превентивно) |
| Какова частота по окончании первого месяца? |
| • Эмпирическая: попытаться найти пороговую дозу (ЗПП или инфузии СЗП) и интервал для каждого пациента |
*Примечание: ЗПП - заменное переливание плазмы; СЗП — свежезамороженная плазма
Отличие в течении заболевания от Д+ ГУС заключается также в том, что Д+ ГУС протекает циклически, остро, не имея тенденции к рецидивам, в то время как аГУС протекает волнообразно и хронически. Прогресс, отмеченный в последнее десятилетие в понимании механизмов развития аГУС, открыл путь к новым терапевтическим подходам. В настоящее время проводится лечение препаратом экулизумаб, получены обнадеживающие результаты.
Трансплантация почек при аГУС. Чрезвычайно высок риск возврата аГУС при мутациях CFH, CFI, С3, реже – при мутациях генов МСР. ЗПП проводится до и после трансплантации. Как вариант терапии рассматривается комбинированная трансплантация печени и почек или только печени при сохранной функции почек.
Дата добавления: 2017-10-04; просмотров: 1980;











