ОСновы расчета процесса массообмена (абсорбции)
Рассмотрим процесс массообмена между газовой и жидкой фазами (рис. 5.1).
Рисунок 5.1 - Схема процесса массообмена между газом и жидкостью
Между газовой фазой Gи жидкой фазой Lимеется поверхность раздела. Пусть концентрация газового компонента в газовой среде будет больше, чем в жидкой. На некотором расстоянии от поверхности раздела фаз в каждой из фаз проходит интенсивная конвективная диффузия молекул, и можно считать, что концентрация газового компонента у во всех точках газовой фазы и концентрация этого же компонента х во всех точках жидкой фазы будут постоянными. В пограничных слоях с разных сторон поверхности раздела фаз движение молекул осуществляется как молекулярной, так и конвективной диффузией. Скорость конвективной диффузии значительно больше скорости молекулярной диффузии. Чем ближе к поверхности раздела фаз, тем меньше становится скорость конвективной диффузии и возрастает скорость молекулярной диффузий. Таким образом, для того чтобы газовый компонент растворился в жидкости, он должен из общей массы газовой смеси в результате конвективной диффузии подойти к пограничному слою, под влиянием молекулярной диффузии перейти поверхность раздела фаз и в результате конвективной диффузии проникнуть в жидкость.
В процессе перехода из газовой в жидкую фазу концентрация газового компонента постепенно уменьшается в газовой фазе и возрастает в жидкой. Переход газового компонента из газовой фазы в жидкую будет проходить до тех пор, пока концентрация его в этих двух фазах не станет равновесной. Следовательно, движущая сила процесса массообмена может быть выражена разностью концентраций газообразного компонента ун—yр=Δ в газовой фазе и хр—хн=Δ в жидкой фазе. Равновесная концентрация поглощаемого компонента yр в газовой фазе, которая характеризует окончание процесса массообмена, может быть определена из закона Генри по формуле

где Мк, Мсм - молекулярные массы соответственно газового компонента и смеси газа, в котором находится этот компонент, кг; 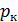 и
и 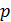 - парциальное давление газового компонента в смеси и общее давление газовой смеси, Н/м2.
- парциальное давление газового компонента в смеси и общее давление газовой смеси, Н/м2.
Движущая сила массообмена неодинакова на входе газа в аппарат и на выходе его из аппарата. Поэтому при расчете аппаратов для химической очистки газа в формулу (5.7) следует подставлять ее среднее значение. Если обозначить Δ1 движущую силу массообмена на входе газа в аппарат, а Δ2 - на выходе из аппарата, то в аппаратах, в которых между газом и жидкостью осуществлен принцип противотока, значение средней движущей силы массообмена будет при Δ1/Δ2>2:

При условии 0,5<Δ1/Δ2<2

В противоточных аппаратах газ перед выходом из аппарата соприкасается со свежей жидкостью, которая способна в большей мере поглощать определенный газообразный компонент, и в результате газ более полно очищается, чем в прямоточных аппаратах. Поэтому в противоточных аппаратах значение движущей силы массообмена (абсорбции) больше, чем в прямоточных.
Коэффициент массопередачи, определяющий скорость абсорбции, может быть представлен из уравнения (5.7) следующей формулой:

Таким образом, коэффициент массопередачи определяет количество газового компонента, который переходит из газовой среды в жидкую через единицу поверхности раздела (F=l) при Δср=1. Для определения коэффициента массопередачи выразим уравнение конвентивного массообмена между газовой и жидкой фазами.
Количество газового компонента, которое перейдет из газовой фазы к поверхности раздела фаз, будет:

Количество газового компонента, которое перейдет от поверхности раздела фаз в жидкость:

где 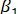 ,
, 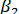 - коэффициенты массоотдачи соответственно для газовой и жидкой фаз, м/с. Представим, что линия равновесия фаз будет прямой с тангенсом угла наклона m. Ее уравнение имеет вид
- коэффициенты массоотдачи соответственно для газовой и жидкой фаз, м/с. Представим, что линия равновесия фаз будет прямой с тангенсом угла наклона m. Ее уравнение имеет вид
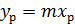
Из этого уравнения выразим концентрацию компонента в жидкой фазе через его концентрацию в газовой фазе:
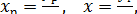
где уг - концентрация компонента в газовой фазе, равновесная с его концентрацией в общей массе жидкой фазы.
Подставив эти значения в уравнение (5.13) и сделав преобразования в уравнениях (5.12) и (5.13), получим
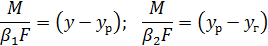
Сложив эти уравнения, получим выражение движущей силы абсорбции:

Обозначив выражение в скобках через 1/К, найдем выражение коэффициента массопередачи (абсорбции):

Член 1/ 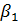 выражает сопротивление переходу газообразного компонента в газовой фазе, а член
выражает сопротивление переходу газообразного компонента в газовой фазе, а член 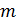 /
/ 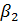 - в жидкой фазе. Для хорошо растворимых газов процесс абсорбции определяется в основном сопротивлением в газовой фазе; в этом случае сопротивление жидкой фазы мало и им можно пренебречь. При плохо растворимых газах можно пренебречь сопротивлением газовой фазы и учитывать только сопротивление жидкой фазы. Размерность коэффициента абсорбции К может быть получена из формулы (5.11) в зависимости от размерности движущей силы процесса абсорбции:
- в жидкой фазе. Для хорошо растворимых газов процесс абсорбции определяется в основном сопротивлением в газовой фазе; в этом случае сопротивление жидкой фазы мало и им можно пренебречь. При плохо растворимых газах можно пренебречь сопротивлением газовой фазы и учитывать только сопротивление жидкой фазы. Размерность коэффициента абсорбции К может быть получена из формулы (5.11) в зависимости от размерности движущей силы процесса абсорбции:
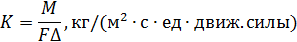
Если Δ выражена в единицах объема (кг/м3), то Кс будет выражен в кг/(м2·с·кг/м3) или м/с.
При выражении Δ через единицы давления (Н/м2) Kр будет иметь размерность кг/(м2·с·Н/м2) или с/м.
Если Δ выражена в массовых единицах (кг/кг), то
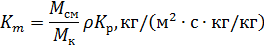
Связь между Кр и Кс выражается зависимостью
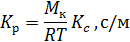
Коэффициент массоотдачи определяют по эмпирическим формулам, найденным опытным путем для различных процессов. По формулам (5.9), (5.10), (5.15) получают точные результаты для расчетов процесса абсорбции газов в случае, если линия равновесия является прямой. В других случаях расчет аппаратов осуществляют графо- аналитическим методом (расчетом числа единиц переноса).
5.3 Адсорбционная очистка газов от сернистого ангидрида
Сухие методы очистки газов от S02 твердыми поглотителями привлекают внимание исследователей и производственников своей простотой, компактностью оборудования относительно небольшой величиной капитальных затрат на их сооружение. Однако энергозатраты и эксплуатационные расходы при сухой очистке газов являются значительными. При сухих методах очистки в дымовую трубу выбрасываются нагретые газы (более чем до 100° С), в результате чего улучшается (по сравнению с мокрыми методами очистки) их рассеивание в атмосфере.
В настоящем разделе рассмотрены адсорбционные методы очистки газов от S02, применение которых в агломерационном производстве в ряде случаев может оказаться целесообразным. В качестве поглотителей S02 можно применять угольные сорбенты, силикагели и синтетические смолы. Угольные сорбенты имеют очень развитую поверхность (до 1500 м2/г). На этой поверхности из дымовых газов при 40 - 150 °С адсорбируются кислород и пары воды. В этих условиях на поверхности пор угля происходит окисление S02 в S03, который взаимодействует с адсорбированной водой и образует серную кислоту. Она постепенно заполняет поры адсорбента и процесс очистки газа прекращается. Лучшим угольным сорбентом для очистки газов от S02 является каменноугольный адсорбционный кокс, полученный из предварительно окисленного воздухом каменного угля и сформированный прессованием. Для осуществления промышленного метода очистки газов от S02 насыщенный сорбент нужно регенерировать. Существуют три вида регенерации насыщенного сорбента: продувка сорбента инертным газом при 200 - 450 °С; промывка сорбента водой или водным раствором аммиака с получением разбавленной серной кислоты или раствора сульфата аммония; обработка сорбента восстановительным газом при 600 - 900 °С с образованием сероводорода, являющегося сырьем для получения чистой серы и серной кислоты.
Тот или иной способ регенерации связан с местными условиями (наличием аммиачной воды, восстановительного газа, вторичных энергетических ресурсов).
Силикагели по сравнению с угольными сорбентами, имеют более низкую поглотительную способность, что связано, по-видимому, с меньшей поверхностью пор (600 м2/г). Ряд исследователей считают, что силикагели перспективны для промышленной очистки небольших количеств газа от S02. Синтетические смолы имеют большую адсорбционную емкость, чем другие поглотители. Лучшими поглотителями S02 являются анионит ЭДЭ-10П и цеолит 5А. Их емкость составляет 18-20%. Отработанные аниониты регенерируют щелочными растворами.
Очистка газов от S02 угольными адсорбентами в кипящем слое не требует предварительной глубокой очистки от пыли, что является существенным преимуществом этого метода. Однако зерна сорбента в кипящем слое изнашиваются, что приводит к дополнительному расходу сорбента. Схема этого процесса представлена на рис. 5.2. [9]
1 - бункер с сорбентом; 2 - затвор; 3 - многополочный адсорбер; 4 - циклон; 5 - приемный бункер; 6 - десорбер; 7 - подогреватель; 8 - газодувка; 9 - сито.
Рисунок 5.2 - Схема очистки газов от S02 в кипящем слое сорбента
Газ, подлежащий очистке, поступает в многополочный адсорбер кипящего слоя, проходит через дырчатые полки снизу вверх и поддерживает сорбент на полках в псевдосжиженном состоянии.
1 - труба Вентури; 2 - сепаратор влаги и пыли; 3 - абсорберы; 4 - сборник кислоты; 5 - циркуляционный насос.
Рисунок 5.3 - Схема процесса «Лурги» очистки газов от S02.
Сорбент в виде гранул угля поступает в адсорбер из бункера через питатель. Далее газ поступает в циклон, где он очищается от золы, которая свободно проходит с газом через адсорбер. Очищенный газ выбрасывается через дымовую трубу в атмосферу. Из адсорбера сорбент через приемный бункер и питатель самотеком попадает в десорбер, представляющий собой стальной цилиндр, обогреваемый снаружи. Температура сорбента в нем доводится до 400 -450 °С. В десорбере происходит выделение S02. Для лучшей десорбции адсорбер продувается током рециркулирующего газа, к которому подмешивается инертный газ или водяной пар. Для побуждения циркуляции установлена газодувка, а для нагрева инертного газа - подогреватель. S02 в смеси с инертным газом отводится к потребителю. Сорбент из десорбера попадает на сито, где отсеивается мелочь, появившаяся в результате механического износа зерен угля. Просев удаляется из системы, а крупные зерна идут на повторное использование в адсорбере. Рекомендуемый размер гранул сорбента 1,5 - 3,0 мм, соответствующая скорость газового потока 1,3 -1,5 м/с; содержание S02 в десорбированной газовой смеси 40 - 50%. При применении в качестве сорбента специальных углей для поглощения 1 т S02 нужно пропустить через адсорбер 5 - 6 т угля.
Потери адсорбента зависят от скорости газа и прочности зерен. При очистке газа с содержанием 0,2% S02 и применением в качестве сорбента угля типа СКТД потери сорбента доходят до 40 кг на каждую тонну уловленного S02. Перспективы применения данного способа значительно повысятся при создании более дешевого и прочного сорбента. Применение формированных гранулированных сорбентов на основе каменноугольного кокса и полукокса может существенно повысить конкурентоспособность данного метода очистки газов от S02.
Очистка газов в слое неподвижного сорбента разработана в нескольких вариантах. Известны процессы, предложенные фирмами «Лурги» и «Хитачи», а также процесс Штратмана.
Принципиальная схема процесса «Лурги»[9] представлена на рис. 5.3. Загрязненный газ предварительно очищают от пыли в трубе Вентури и сепараторе. Затем его направляют на адсорбцию. Устанавливают два параллельно включенных адсорбера. Они работают
попеременно: в одном происходит поглощение S02 из газа, а во вто-
ром его десорбция. В поглотительном адсорбере газ, содержащий
S02, проходит через увлажненный слой сорбента (активированного
угля). Сернистый газ адсорбируется сорбентом, окисляется до S03
и превращается в серную кислоту. Затем адсорбер переводят на ре-
жим регенерации, для чего включают орошение сорбента водой. Отмытая разбавленная 10—15%-ная серная кислота поступает в сборник, а оттуда насосом подается в трубу Вентури, для очистки и охлаждения газов. В трубе Вентури за счет испарения воды концентрация серной кислоты повышается. При очистке хорошо обеспыленных газов концентрацию серной кислоты удается повысить до 65%, а при очистке запыленных газов - до 25%. Степень очистки газа на опытной установке достигала 98-99%. Поглотитель работал более трех лет без потери активности.
5.4 Каталитическая очистка газов
Главным источником загрязнения атмосферы СО и SO2в энергетике являются газы, полученные при сжигание различных газов.
Различными организациями проделана большая работа по разработке наиболее эффективных катализаторов и технологии процесса окисления СО. Однако задача каталитической очистки от СО осложняется наличием в газах S02 и пыли. При этом содержание пыли в очищенном газе до катализа с применением стационарного слоя не должно превышать 20 - 50 мг/м3.
Такая глубокая очистка может быть получена лишь в электрофильтрах, тканевых фильтрах или трубах Вентури.
В настоящее время имеется большое число катализаторов реакции окисления СО в СО2. Это оксиды металлов Fe2О3, CuO, Сr2О3, MnО2, V2О5 и другие, смеси этих оксидов, металлы платиновой группы, в частности палладий. Хорошие результаты дает промотированние окисных катализаторов металлами платиновой группы. Довольно подробно изучен марганцевокислый катализатор,
который оказался пригодным при больших объемных скоростях процесса.
Однако все окисные катализаторы насыщаются S02 со скоростью, зависящей от концентрации S02 в газах, температуры и вида катализатора. Самым устойчивым является катализатор из оксида хрома на γ-глиноземе; однако и его активность со временем падает в присутствии S02. Потеря катализаторами активности в присутствии в газах S02 объясняется образованием сульфатов. Катализаторы из оксидов металлов непригодны для окисления СО в СО2 в присутствии S02. Они являются, эффективными лишь для бессернистых газов или газов, предварительно очищенных от S02.
Наиболее надежными катализаторами, которые длительное время могут работать в присутствии S02, являются катализаторы из металлов платиновой группы, в частности палладиевые.
Они надежно работают при температуре выше 300оС. При больших содержаниях серы в газах целесообразно производить комплексную их очистку от СО и S02 окислением на катализаторах с последующей переработкой S03 в серную кислоту.
Схема комплексной очистки газов от СО и S02 представлена на рис. 5.4. Запыленные газы очищаются от крупных фракций пыли в аппаратах циклонного типа и с содержанием ее около 1 - 2 г/м3 поступают в аппараты тонкой очистки сухим способом. В качестве аппаратов тонкой очистки можно применить электрофильтры или тканевые фильтры, которые обеспечивают более глубокую очистку от пыли (до 10 - 20 мг/м3) и являются в данном случае предпочтительными, так как полностью исключают засорение слоя катализатора.
1 - рукавный фильтр; 2 - контактный аппарат; 3 - холодильник-конденсатор; 4 - сборник серной кислоты; 5 - эксгаустер; 6 - дымовая труба.
Рисунок 5.4 - Схема комплексной очистки газов от пыли, СО и S02
Очищенные от пыли газы поступают в контактный аппарат, где СО окисляется в СО2, aS02 в S03. Далее газы поступают в холодильник-конденсатор, охлаждаемый водой (или воздухом), где температура газов снижается и происходит конденсация серной кислоты, которая образуется из S03 и водяных паров. В установке такого типа можно получать H2S04 концентрацией до 80%. Серная кислота из конденсатора через гидрозатвор отводится в сборник, а очищенные от СО и S02 газы эксгаустером выбрасываются в дымовую трубу. Процесс очистки непрерывный, степень очистки от СО приближается к 100%, а от S02 к 90%.
1 - кожух; 2 - крышка; 3, 4 - кассеты с катализатором для окисления соответственно S02 в S03 и СО в СО2; 5 - трубчатый теплообменник; 6 - смесительная решетка; 7 - горелочное устройство; 8 - трубопровод для подачи дополнительного топлива.
Рисунок 5.5 - Схема контактного аппарата для окисления СО и S02.
Схема контактного аппарата конструкции Гидрогазоочистки представлена на рис. 5.5. Контактный аппарат представляет собой трубчатый теплообменник, внутри которого в полом цилиндре размещены две кассеты с катализаторами. Нижняя кассета заполнена палладиевым катализатором для окисления СО в СО2, верхняя кассета - катализатором из пятиокиси ванадия для окисления S02 в S03.
Нагретые до 150° С агломерационные газы поступают в теплообменник контактного аппарата, где подогреваются теплом отходящих из аппарата газов. Если этого тепла окажется недостаточно, чтобы нагреть газы до температуры процесса окисления СО (300—350° С) и температуры окисления S02 (400—450°С), то нужно расходовать дополнительное тепло сжиганием топлива, например доменного газа. Дополнительное топливо подводится в нижнюю часть аппарата специальным горелочным устройством.
5.4.1 Очистка газов от сернистого ангидрида каталитическим окислением
Данный метод основан на окислении S02 в S03 на катализаторе с последующей абсорбцией S03 и образованием серной кислоты. Окисление S02 в S03 протекает по реакции S02+ 1/2О2= S03+ +96 кДж/моль.
Константа равновесия этой реакции определяется уравнением
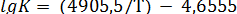 (5.16)
(5.16)
Вычисленные по этой формуле константы равновесия реакции и соответствующие величины степени превращения S02 в S03 имеют следующие значения:
Температура, °С………390 425 475 525 600 650
Константа равновесия
КР, МПа……………….. 57,5 24,5 8,23 3,2 0,95 0,47
Степень превращения
S02 в S03, %.....................99,0 98,4 95,2 91,0 73,0 57,0
Таким образом, по условиям равновесия повышение температуры не благоприятствует окислению S02 в S03. Энергия активации этой реакции очень велика, поэтому без катализатора реакция гомогенного окисления S02 в S03 практически не проходит даже при высокой температуре.
В качестве катализатора при производстве серной кислоты применяют в основном контактную массу БАВ, названную по начальным буквам элементов, входящих в ее состав (бария, алюминия, ванадия), и контактную массу СВД (сульфованадиеводиатомовую). Контактную массу формуют в виде гранул, таблеток или колец.
Зависимость константы скорости реакции окисления S02 в S03 на катализаторах БАВ и СВД приведена на рис. 5.6. Перелом кривой при 440 °С связан с изменением энергии активизации в этой точке. Таким образом, при увеличении температуры с 400 до 500 °С константа скорости реакции увеличивается более чем в 30 раз, а константа равновесия уменьшается в 9 раз. Следовательно, процесс окисления S02 в S03 зависит от двух величин, одна из которых с повышением температуры увеличивается, а другая уменьшается. Анализ показывает, что кривая зависимости скорости образования S03 имеет максимум. Наиболее благоприятная температура процесса равна 460 - 480° С. При объемной скорости газов 10000 ч-1 достигается степень окисления S02 не менее 90%.
Рисунок 5.6 - Зависимость константы скорости реакции окисления S02 в S03 от температуры на ванадиевых катализаторах БАВ и СВД.
Высокая температура протекания реакции окисления S02 создает трудности при практическом осуществлении данного процесса в производственных условиях. Как было показано, основными загрязнителями атмосферы S02 являются аглофабрики и котельные, отходящие газы которых имеют температуру около 150° С, при которой контактное окисление газов является невозможным. Поэтому в схеме контактного окисления нужно предусмотреть нагрев агломерационных газов до 450 °С. Источником тепла может явиться готовый агломерат, нагретый до высокой температуры в зоне обжига. Этот агломерат нужно охладить, поэтому целесообразно совместить узел охлаждения агломерата и нагрева газов перед контактным аппаратом.
Принципиальная схема контактного окисления S02, содержащегося в агломерационных газах, до S03 представлена на рис. 5.7. Агломерационные газы, содержащие S02, проходят грубую очистку от пыли в инерционном пылеуловителе и тонкую очистку в электрофильтре. Затем эти газы подогревают со 150 до 450 °С нагретым воздухом, охлаждающим агломерат. Превращение S02 в S03 происходит в контактном аппарате. После этого агломерационные газы охлаждают до 250 °С в теплообменнике воздухом, подаваемым на охлаждение агломерата. Образовавшийся при охлаждении туман серной кислоты улавливают электрофильтром. Очищенный воздух из электрофильтра выбрасывают в атмосферу, а серную кислоту сливают в сборник и используют в качестве товарного продукта. Данная схема очистки требует существенной переделки агломерационной машины.
1 - инерционный пылеуловитель; 2 - электрофильтр для тонкой очистки газов от пыли; 3 - контактный -аппарат для окисления S02 в S03; 4 - теплообменник для охлаждения газов и выделения из них серной кислоты; 5 - электрофильтр для улавливания серной кислоты
Рисунок 5.7 - Схема процесса очистки дымовых газов от S02.
Разновидностью описанного способа очистки газов от S02 является процесс «Кийоура ТИТ», разработанный в Японии. Данный процесс отличается тем, что окисленный горячий газ охлаждают до температуры ниже точки росы серной кислоты и вводят в газовый поток газообразный аммиак, который взаимодействует с S02 с образованием сульфата аммония. Последний образуется в виде крупных кристаллов (≈100 мкм), благодаря чему хорошо улавливается в электрофильтрах.
Разработаны схемы последовательного двойного контактного окисления S02. В одной из этих схем газы после окисления в первом контактном аппарате и отделения из них серной кислоты поступают во второй контактный аппарат. Благодаря этому общая степень очистки является относительно высокой. Недостатком данного способа является большой расход тепла на нагрев газов перед вторым контактным аппаратом и большое число аппаратуры. Агломерационные газы содержат наряду с S02 также СО, которая неблагоприятно влияет на процесс контактного окисления S02 в S03. Установлено, например, что в присутствии СО при 450 °С и содержании 0,4% S02, объемной скорости газа 12 000 ч-1 степень окисления S02 снижается с 90 до 80%.
Таким образом, очистка агломерационного газа в контактных аппаратах по схеме очистки дымового газа котельных недостаточно эффективна. Поэтому целесообразно применять комплексную очистку газа от S02 и СО, т. е. окислять СО в СО2 на палладиевом катализаторе. При такой схеме очистки достигают подачи на ванадиевый катализатор газа, очищенного от СО, и повышения его температуры примерно на 100 °С за счет окисления СО в СО2. В результате этого на ванадиевом катализаторе достигают необходимой температуры.
Дата добавления: 2017-09-01; просмотров: 1767;











