Химическое соединение
Для химического соединения характерны следующие отличительные особенности:
1) Кристаллическая решетка отличается от решеток компонентов, образующих соединение.
2) В соединении всегда сохраняется простое кратное соотношение его компонентов. Это позволяет выразить их состав простой формулой AmBn, где А и В – соответствующие элементы, n и m – простые числа.
3) Свойства соединения резко отличаются от свойств образующих его компонентов.
4) Температура плавления (диссоциации) постоянная.
5) Образование химического соединения сопровождается значительным тепловым эффектом.
Химические соединения образуются между компонентами, имеющими большое различие в электронном строении атомов и кристаллических решеток.
В качестве примера типичных химических соединений можно назвать такие, как соединения магния с элементами IV-VI групп периодической системы: Mg2Sn, Mg2Pb, Mg2P, Mg3Sb, MgS и другие.
Соединения одних металлов с другими носят общее название интерметаллических соединений, или интерметаллидов.
Соединения металла с неметаллом (нитриды, оксиды, карбиды и др.) могут иметь как металлическую, так и ионную связь. Соединения, имеющие металлическую связь, называют металлическими соединениями.
Большое число химических соединений, образующихся в металлических сплавах, отличается от типичных химических соединений, так как не подчиняется законам валентности и не имеет постоянного состава. Рассмотрим наиболее важные химические соединения, образующиеся в сплавах.
7.2.1.Фазы внедрения. Переходные металлы (Fe, Mn, Cr, Mo и др.) образуют с углеродом, азотом, бором и водородом, т.е. с элементами, имеющими малый атомный радиус, соединения: карбиды, нитриды, бориды и гидриды. Они имеют общность строения и свойств и часто называются фазами внедрения.
Фазы внедрения имеют формулу М4Х (Fe4N, Mn4N и др.), M2X (W2C, Fe2N и др.), MX (WC, TiC,TiN и др.).
Кристаллическая структура фаз внедрения определяется соотношением атомных радиусов неметалла (Rx) и металла (RM). Если Rx/ RM <59, то атомы в этих фазах расположены по типу одной из кристаллических решеток: кубической или гексагональной, в которую внедряются атомы неметалла, занимая в ней определенные поры.
Фазы внедрения являются фазами переменного состава. Карбиды и Нитриды обладают высокой твердостью. Кристаллическая решетка фаз внедрения отличается от решетки металла.
7.2.2. Электронные соединения (фазы Юм-Розери). Эти соединения чаще образуются между одновалентными (Cu, Ag, Au, Li, Na) металлами или металлами переходных групп (Fe, Mn, Co и др.), с одной стороны, и с простыми металлами с валентностью от 2 до 5 (Be,
Mg, Zn, Cd, Al и др.), с другой стороны. Соединения этого типа имеют определенное соотношение числа валентных электронов к числу атомов, т.е. определенную электронную концентрацию. Эти соотношения, как показал английский металлофизик Юм-Розери, могут быть 3/2, 21/13 и 7/4, причем каждому соотношению соответствует определенная кристаллическая решетка: объемно центрированная кубическая или гексагональная решетка, сложная кубическая решетка и гранецентрированная кубическая решетка, соответственно.
7.2.3.Фазы Лавеса. Эти фазы имеют формулу АВ2 и образуются между элементами, атомные диаметры которых находятся примерно в соотношении 1 : 1,2. Например, MgZn2, TiCr2 и др. Фазы Лавеса встречаются как упрочняющие интерметаллиды в жаропрочных сплавах.
Твердые растворы
Твердыми растворами называют фазы, в которых один из компонентов сплава сохраняет свою кристаллическую решетку, а атомы других (или другого) компонентов располагаются в решетке первого компонента (растворителя), изменяя ее размеры. Таким образом, твердый раствор, состоящий из нескольких компонентов, имеет один тип решетки и представляет собой одну фазу. Кроме того, твердый раствор существует не при определенном соотношении компонентов (как в химическом соединении), а в интервале концентраций.
Различают твердые растворы замещения, внедрения и вычитания.
При образовании твердых растворов замещения атомы растворенного компонента замещают часть атомов растворителя в его кристаллической решетке (рис.26, б).
При образовании твердого раствора внедрения (рис.26, в) атомы растворенного компонента располагаются в межузлиях (пустотах) кристаллической решетки растворителя.
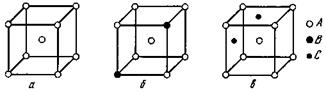
Рис.26. Кристаллическая решетка ОЦК: а - чистый металл, б - твердый раствор замещения, в - твердый раствор внедрения; А - атомы основного металла, В – атомы замещения, С – атомы внедрения.
Металлы могут в той или иной степени взаимно растворяться друг в друге в твердом состоянии, образуя твердые растворы замещения с ограниченной или неограниченной растворимостью. Твердые растворы с неограниченной растворимостью образуются при следующих условиях:
1) Компоненты должны обладать одинаковыми по типу (изоморфными) кристаллическими решетками.
2) Различие в атомных размерах компонентов должно быть незначительным и не превышать 10-15%.
3) Компоненты должны принадлежать к одной и той же (или родственной) группе периодической системы элементов.
В некоторых сплавах (например, Cu-Au, Fe-Al), образующих при высоких температурах растворы замещения (с неупорядоченным чередованием атомов компонентов), при медленном охлаждении или длительном нагреве при определенных температурах протекает процесс перераспределения атомов. Твердые растворы, устойчивые при сравнительно низких температурах, получили название упорядоченных твердых растворов, или сверхструктур. Упорядоченные твердые растворы можно рассматривать как промежуточные фазы между твердыми растворами и химическими соединениями. В отличие от химических соединений кристаллическая решетка упорядоченных твердых растворов представляет собой решетку растворителя. Образование упорядоченных твердых растворов сопровождается изменением физических и механических свойств. Прочность обычно возрастает, а пластичность падает.
Способность к образованию твердых растворов присуща не только чистым элементам, но и химическим соединениям. В этих случаях сохраняется кристаллическая решетка химического соединения, но избыточное количество атомов одного из компонентов может заменять какое-то количество атомов другого компонента. Кроме того, при этом в отдельных узлах могут появляться незанятые места – пустоты. Твердые растворы на базе химических соединений, образование которых сопровождается появлением пустых мест в узлах решетки, называются растворами вычитания.
РЕЗЮМЕ
Под сплавом подразумевают вещество, полученное сплавлением двух или более элементов.
Совокупность фаз, находящихся в состоянии равновесия, называют системой. Фазой называют однородные составные части системы, имеющие одинаковый состав, кристаллическое строение и свойства, одно и то же агрегатное состояние и отделенные от составных частей поверхности раздела. Под структурой понимают форму, размеры и характер взаимного расположения фаз в металлах и сплавах. Компоненты в сплаве могут образовывать механические смеси, химические соединения или твердые растворы.
Механическая смесь двух компонентов образуется тогда, когда они не способны к взаимному растворению в твердом состоянии и не вступают в химическую реакцию с образованием соединения.
Химические соединения образуются между компонентами, имеющими большое различие в электронном строении атомов и кристаллических решеток. Строение и свойства химического соединения отличаются от строения и свойств создавших его компонентов.
Наиболее важные химические соединения, образующиеся в сплавах:
- Фазы внедрения
- Электронные соединения (фазы Юм-Розери)
- Фазы Лавеса
Твердыми растворами называют фазы, в которых один из компонентов сплава сохраняет свою кристаллическую решетку, а атомы других (или другого) компонентов располагаются в решетке первого компонента (растворителя), изменяя ее размеры.
Различают твердые растворы замещения, внедрения и вычитания.
Вопросы для повторения
1. Что такое сплав?
2. Дать определение терминам «фаза», «система», «структура».
3. Когда в сплаве образуется механическая смесь компонентов, а когда - химическое соединение?
4. Что такое твердые растворы? Какие виды твердых растворов Вы знаете?
8. ДИАГРАММЫ СОСТОЯНИЯ
Диаграмма состояния представляет собой графическое изображение состояния сплава. Диаграммы состояния строят для условий равновесия или условий, достаточно близких к ним. Поэтому диаграмма состояния может также называться диаграммой равновесия.
Равновесное состояние соответствует минимальному значению свободной энергии. Этого состояния можно достичь при отсутствии перегрева или переохлаждения сплава. Диаграмма состояния представляет собой теоретический случай, т.к. равновесные превращения (без переохлаждения или перегрева) на практике не могут совершать-
ся. Обычно на практике используются превращения, происходящие при малых скоростях нагрева или охлаждения.
Общие закономерности сосуществования устойчивых фаз могут быть выражены в математической форме в виде правила фаз или закона Гиббса.
Правило фаз дает количественную зависимость между степенью свободы системы и количеством фаз компонентов.
Под числом степеней свободы (вариантностью) системы понимают число внешних и внутренних факторов (температура, давление, концентрация), которое можно изменять без изменения числа фаз в системе.
Правило фаз.
С= k - f + 2
С - число степеней свободы, k- число компонентов, f – число фаз, 2 – число внешних факторов.
Правило фаз справедливо только для равновесного состояния.
Независимыми переменными в уравнении правила фаз являются концентрация, температура и давление. Если принять, что все превращения в металле происходят при постоянном давлении, то число переменных уменьшится на единицу.
С= k - f + 1
Пример. Посмотрим, как изменяется степень свободы однокомпонентной системы (k=1) для случая кристаллизации чистого металла. Когда металл находится в жидком состоянии, т.е. f =1 (одна фаза - жидкость), число степеней свободы равно 1. Температура в данном случае может изменяться, не изменяя агрегатного состояния. В момент кристаллизации f =2 (две фазы – твердая и жидкая), С=0. Это значит, что две фазы находятся в равновесии при строго определенной температуре (температура плавления), и она не может быть изменена до тех пор, пока одна фаза не исчезнет, т.е. система не станет моновариантной (C=1).
Дата добавления: 2017-09-01; просмотров: 4884;











