Плавление и кристаллизация. Диаграмма равновесия твердой, жидкой и газообразной фаз. Тройная точка.
Если нагревать твердое тело, то при некоторой температуре оно плавится, т.е. переходит в жидкое состояние. При увеличении температуры увеличивается амплитуда колебаний частичек и при достижении некоторой температуры начинается разрушение кристаллической решетки.
При достижении твердым телом температуры плавления дальнейший подвод теплоты не приводит к повышению его температуры, так как вся подводимая теплота идет на разрушение кристаллической решетки. И только после того как все тело перешло в жидкое состояние ее температура начинает повышаться (рис.1):
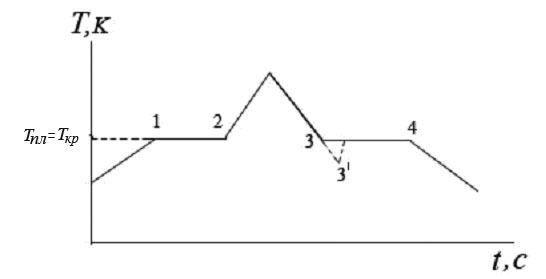
Рис.1. Плавление и кристаллизация твердого тела
Плавление твердого тела протекает изотермично. Горизонтальный участок графика 1 – 2 свидетельствует о том, что теплота, переданная телу, идет на разрушение кристаллической решетки.
Количество теплоты, необходимое для изотермического плавления единицы массы кристаллического вещества называется удельной теплотой плавления.
После окончания процесса плавления (точка 2) образуется жидкая фаза, и ее температура начинает повышаться. При охлаждении жидкости при температуре Tпл = Tкр начинается процесс кристаллизации 3 – 4. При этом выделяется теплота кристаллизации равная теплоте плавления.
Рост кристаллов происходит вокруг центров кристаллизации (частички, пылинки в жидкости). Если жидкость очистить от таких частичек, то она может быть охлаждена до температуры ниже температуры кристаллизации 3 - 3′. Это состояние переохлажденной жидкости неустойчивое. При достаточном переохлаждении начинается самопроизвольное образование зародышей кристаллов, и расплав быстро кристаллизуется. При этом его температура повышается до Tкр.
В обычных условиях в расплаве находится много центров кристаллизации. Поэтому в результате кристаллизации образуется множество мелких кристалликов, которые срастаются. При этом образуется поликристаллическое вещество.
Переход твердое тело – жидкость, также как и обратный переход – фазовые переходы I рода. Устойчивое динамическое равновесие двух фаз вещества возможно только в некотором интервале температур и давлений. Равновесию этих фаз соответствует кривая плавления p = f(T). Каждая точка этой кривой соответствует равновесию твердой и жидкой фаз вещества при соответствующих давлениях и температурах.
Зависимость температуры фазового перехода от давления определяется уравнением Клапейрона-Клаузиуса, справедливого для всех фазовых переходов I рода:
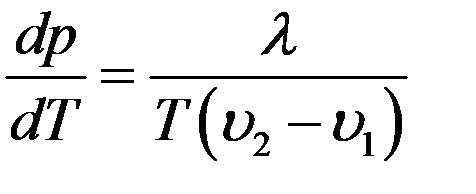 (1)
(1)
В случае плавления υ2 – удельный объем жидкой фазы, υ1 – удельный объем твердой фазы, λ – удельная теплота плавления. Для большинства веществ удельный объем жидкой фазы больше чем удельный объем твердой фазы (υ2 > υ1), поэтому dp/dT > 0, касательная к кривой плавления составляет острый угол с осью T (рис.2):

Рис.2. Кривая плавления
Эта кривая делит плоскость на две части, соответствующие твердой и жидкой фазам вещества. Повышение давления приводит к увеличению температуры плавления и наоборот.
Для некоторых веществ (лед, чугун, висмут) υ2 < υ1. Для этих веществ dp/dT < 0, кривая плавления – пунктирная линия (рис.2). Повышение давления приводит к уменьшению температуры плавления и наоборот.
Твердое тело может образовываться конденсацией пара в кристалл, минуя жидкую фазу. При этом также выделяется теплота конденсации. Процесс, обратный конденсации, называется сублимацией или возгонкой. Благодаря сублимации ощущается запах нафталина, камфары, сохнет белье на морозе.
При определенных значениях давления и температуры твердое тело и пар могут существовать в равновесии. Такой пар также называется насыщенным. Зависимость давления насыщенного пара от температуры подчиняется уравнению Клапейрона-Клаузиуса (1). Удельный объем, пара всегда больше удельного объема твердого тела, поэтому dp/dT > 0, касательная к кривой сублимации составляет острый угол с осью T (рис.3):
Рис.3. Кривая сублимации
Сублимация, как и плавление, связана с разрушением кристаллической решетки. Для этого необходима энергия, которая называется теплотой сублимации.
Количество теплоты необходимое для испарения единицы массы твердого тела при постоянной температуре называется удельной теплотой сублимации.
Очевидно, что теплота сублимации равна сумме теплоты плавления и теплоты парообразования.
Как было показано ранее равновесие жидкости и пара возможно при определенных значениях давления и температуры. Кривая кипения p(T) заканчивается в критической точке и также описывается уравнением Клапейрона-Клаузиуса.
Согласно уравнению Клапейрона-Клаузиуса все три кривые: сублимации-кристаллизации, парообразования-конденсации, плавления-кристаллизации должны иметь разный наклон к оси температуры, так как удельная теплота фазового перехода λ в уравнении Клапейрона-Клаузиуса (1) разная для всех этих фазовых переходов.
Следовательно, все эти три кривые должны пересекаться в одной точке. Эта точка называется тройной точкой (рис.4):
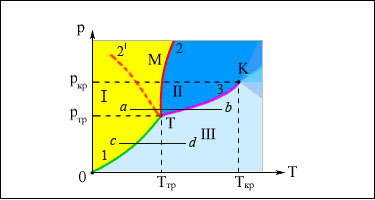
Рис.4. Типичная фазовая диаграмма вещества. K – критическая точка, T – тройная точка. Область I – твердое тело, область II – жидкость, область III – газообразное вещество. 1 – кривая сублимации, 2 – кривая плавления (dp/dT > 0), 2′ - кривая плавления (dp/dT < 0), 3 – кривая кипения.
При температуре и давлении соответствующих тройной точке вещество существует одновременно в трех фазах: твердой, жидкой и газообразной. Все три фазы вещества в этой точке будут находиться в динамическом равновесии. Для разных веществ давление тройной точки и температура тройной точки разные.
Три кривые разбивают координатную плоскость на три области: твердой жидкой и газообразной фаз вещества. Любая точка в одной из этих областей соответствует однофазному состоянию вещества. Точка, лежащая на одной из трех кривых, соответствует двухфазному равновесному состоянию. В тройной точке наблюдается равновесие трех фаз.
Совокупность трех кривых называется диаграммой состояния данного вещества или фазовой диаграммой. С помощью диаграммы можно определить, какие фазовые переходы будут наблюдаться у данного вещества при тех или иных процессах, в каком состоянии будет находиться вещество при том или ином сочетании температур и давлений.
Из диаграммы следует, что твердое тело при нагревании не всегда переходит в жидкое состояние. Если нагревать тело при давлении меньшем чем pтр, линия c – d, то оно плавиться не будет, а сразу будет переходить в газообразное состояние (сублимация).
Плавление твердого тела возможно только при давлениях больших, чем Pтр: линия a – b. В точке пересечения прямой с кривой 2 (или 2′) наблюдается плавление твердого тела, в точке пересечения с кривой 3 наблюдается кипение образовавшейся жидкости.
Температура соответствующая тройной точке воды (0,01oC или 273,16 К) выбрана одной из реперных точек при определении единицы измерения температуры в системе CI – Кельвина.
Кельвин равен 1/273,16 части температурного интервала от абсолютного нуля температуры до температуры тройной точки воды.
Некоторые кристаллические тела имеют несколько кристаллических модификаций. Это явление называется полиморфизмом. В этих случаях диаграмма состояния более сложная.
Для любого вещества в динамическом равновесии не может существовать более трех фаз (правило фаз). Поэтому, если вещество может существовать более чем в трех фазах, то и тройных точек будет больше одной.
В каждой тройной точке сходятся только три кривые, каждая из которых соответствует равновесию двух фаз данного вещества. Например, сера может существовать в двух кристаллических модификациях – моноклинной и ромбической (рис.5):
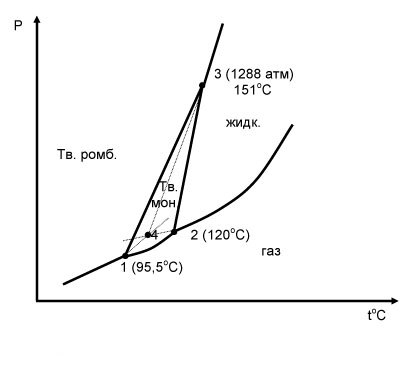
Рис.5. Фазовая диаграмма серы
На диаграмме состояния серы имеются три тройных точки.
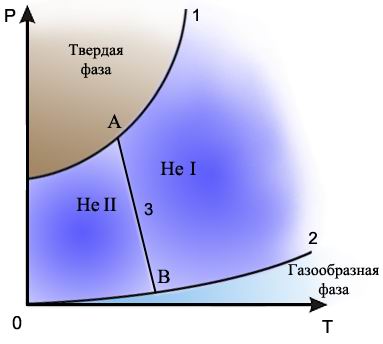
Рис.6. Фазовая диаграмма гелия. 1 - кривая плавления, 2 - кривая испарения, 3 - кривая раздела жидких фаз Не I и Не II, А и В - тройные точки
На диаграмме состояния гелия имеется две тройных точки.
Газодинамика
Лекция 24
Дата добавления: 2017-09-01; просмотров: 2645;











