Молекулы, ионы, свободные радикалы.
Строение молекул и природа химической связи. Виды химических связей. Понятие об электроотрицательности элемента. Поляризация. Дипольный момент. Атомная энергия образования молекул. Методы экспериментального исследования строения молекул.
Строение молекул(молекулярная структура), взаимное расположение атомов в молекулах. В ходе химических реакций происходит перегруппировка атомов в молекулах реагентов и образуются новые соединения. Поэтому одна из фундаментальных химических проблем состоит в выяснении расположения атомов в исходных соединениях и характера изменений при образовании из них других соединений.
Первые представления о структуре молекул основывались на анализе химического поведения вещества. Эти представления усложнялись по мере накопления знаний о химических свойствах веществ. Применение основных законов химии позволяло определить число и тип атомов, из которых состоит молекула данного соединения; эта информация содержится в химической формуле. Со временем химики осознали, что одной химической формулы недостаточно для точной характеристики молекулы, поскольку существуют молекулы-изомеры, имеющие одинаковые химические формулы, но разные свойства. Этот факт навел ученых на мысль, что атомы в молекуле должны иметь определенную топологию, стабилизируемую связями между ними. Впервые эту идею высказал в 1858 немецкий химик Ф.Кекуле. Согласно его представлениям, молекулу можно изобразить с помощью структурной формулы, в которой указаны не только сами атомы, но и связи между ними. Межатомные связи должны также соответствовать пространственному расположению атомов. Этапы развития представлений о строении молекулы метана отражены на рис. 1. Современным данным отвечает структура г: молекула имеет форму правильного тетраэдра, в центре которого находится атом углерода, а в вершинах – атомы водорода.
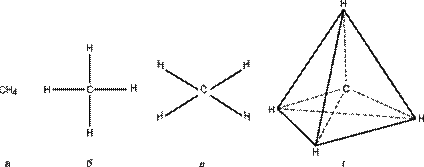
|
| Рис. 1. Четыре способа изображения молекулы метана. а – химическая формула. Указаны лишь число и тип атомов; б – структурная формула; в – реальная схема молекулы; г – пространственное расположение атомов в молекуле. |
Подобные исследования, однако, ничего не говорили о размерах молекул. Эта информация стала доступна лишь с разработкой соответствующих физических методов. Наиболее важным из них оказалась рентгеновская дифракция. Из картин рассеяния рентгеновских лучей на кристаллах появилась возможность определять точное положение атомов в кристалле, а для молекулярных кристаллов удалось локализовать атомы в отдельной молекуле. Среди других методов можно отметить дифракцию электронов при прохождении их через газы или пары и анализ вращательных спектров молекул.
Вся эта информация дает только общее представление о структуре молекулы. Природу химических связей позволяет исследовать современная квантовая теория. И хотя с достаточно высокой точностью молекулярную структуру рассчитать пока не удается, все известные данные о химических связях можно объяснить. Было даже предсказано существование новых типов химических связей.
Молекулы, ионы, свободные радикалы.
Атомы элементов могут образовать три вида частиц, участвующих в химических процессах - молекулы, ионы и свободные радикалы.
Молекулой называется наименьшая нейтральная частица вещества, обладающая его химическими свойствами и способная к самостоятельному существованию. Различают одноатомные и многоатомные молекулы (двух-, трехатомные и т.д.). В обычных условиях из одноатомных молекул состоят благородные газы; молекулы высокомолекулярных соединений, напротив, содержат много тысяч атомов.
Ион - заряженная частица, представляющая собой атом или группу химически связанных атомов с избытком электронов (анионы) или недостатком их (катионы). В веществе положительные ионы всегда существуют вместе с отрицательными. Так как электростатические силы, действующие между ионами, велики, то невозможно создать в веществе сколько-нибудь значительный избыток ионов одного знака.
Свободным радикалом называется частица, обладающая ненасыщенными валентностями, т. е. частица с неспаренными электронами. Такими частицами являются, например ·СН3 и ·NH2. В обычных условиях свободные радикалы, как правило, не могут существовать длительное время, поскольку чрезвычайно реакционноспособны и легко реагируют, образуя инертные частицы. Так, два метильных радикала ·СНз соединяются в молекулу С2Н6 (этан). Протекание многих реакций невозможно без участия свободных радикалов. При очень высоких температурах (например, в атмосфере Солнца) единственными двухатомными частицами, которые могут существовать, являются свободные радикалы (·CN, ·ОН, ·СН и некоторые другие). Много свободных радикалов присутствует в пламени.
Известны свободные радикалы более сложного строения, которые сравнительно стабильны и могут существовать при обычных условиях, например радикал трифенилметил (С6Н5)3С· (с его открытия началось изучение свободных радикалов). Одной из причин его стабильности являются пространственные факторы - большие размеры фенильных групп, которые препятствуют соединению радикалов в молекулу гексафенилэтана.
Дата добавления: 2017-09-01; просмотров: 2865;











