Молекулы, составляющие тело, находятся в состоянии непрерывного беспорядочного (хаотического) движения.
Беспорядочное хаотическое движение молекул называется тепловым движением. Кинетическая энергия теплового движения растет с возрастанием температуры. При низких температурах средняя кинетическая энергия молекулы может оказаться меньше глубины потенциальной ямы E0. В этом случае молекулы конденсируются в жидкое или твердое вещество; при этом среднее расстояние между молекулами будет приблизительно равно r0. При повышении температуры средняя кинетическая энергия молекулы становится больше E0, молекулы разлетаются, и образуется газообразное вещество.
В твердых телах молекулы совершают беспорядочные колебания около фиксированных центров (положений равновесия). Эти центры могут быть расположены в пространстве нерегулярным образом (аморфные тела) или образовывать упорядоченные объемные структуры (кристаллические тела).
В жидкостях молекулы имеют значительно большую свободу для теплового движения. Они не привязаны к определенным центрам и могут перемещаться по всему объему жидкости. Этим объясняется текучесть жидкостей. Близко расположенные молекулы жидкости также могут образовывать упорядоченные структуры, содержащие несколько молекул. Это явление называется ближним порядком в отличие от дальнего порядка, характерного для кристаллических тел.
В газах расстояния между молекулами обычно значительно больше их размеров. Силы взаимодействия между молекулами на таких больших расстояниях малы, и каждая молекула движется вдоль прямой линии до очередного столкновения с другой молекулой или со стенкой сосуда. Слабое взаимодействие между молекулами объясняет способность газов расширяться и заполнять весь объем сосуда. В пределе, когда взаимодействие стремится к нулю, мы приходим к представлению об идеальном газе.
Закономерности броуновского движения. Важную роль в подтверждении справедливости молекулярно-кинетической теории сыграли опыты французского физика Ж. Перрена по изучению количественных закономерностей броуновского движения, выполненные в 1908—1911 гг. Эти опыты были поставлены после того, как А. Эйнштейн в 1905 г. на основе молекулярно-кинетической теории разработал теорию броуновского движения. А.Эйнштейн доказал, что при хаотическом движении броуновской частицы ее смещение от начального положения должно подчиняться закону:
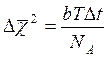 (10.1)
(10.1)
где 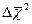 — средний квадрат смещения броуновской частицы за время Δt, b – постоянная, зависящая от формы и размеров броуновской частицы, NA – постоянная Авогадро, Т – абсолютная температура.
— средний квадрат смещения броуновской частицы за время Δt, b – постоянная, зависящая от формы и размеров броуновской частицы, NA – постоянная Авогадро, Т – абсолютная температура.
Наблюдения Перрена полностью подтвердили этот теоретический результат. Регистрируя положения броуновской частицы через равные промежутки времени, Перрен увидел, что движение броуновской частицы весьма запутанно, беспорядочно, а ее смещение от начального положения пропорционально именно корню квадратному из времени.
10.3 Размеры и масса молекул, количество вещества
Молекула – это наименьшая частица вещества, сохраняющая все его химические свойства. Различают молекулу в физическом смысле (физическую молекулу), которую можно уподобить упругому шарику, и химическую молекулу, выраженную формулой атомного состава. Молекулы не всех веществ можно рассматривать как физические, например, молекулы веществ с ионной связью (в частности, NaCl – повареная соль). Это важно, когда рассматриваются соударения молекул или их тепловое движение. Поэтому в формулировке основных положений МКТ чаще всего используют термин «частица».
Размеры молекул очень малы. Если представить молекулу в виде малого шарика, то его радиус имеет порядок величины 10-8 см =10-10 м. Молекулы состоят из атомов. Частицы, образующие атомы - электроны и ядра. Принято считать, что электрон имеет радиус порядка величины 10-11см = 10-13 м, а ядра атомов имеют радиусы примерно 10-12 ÷ 10-13 см = 10-14 ÷10-15 м.
Используя атомистическую теорию строения вещества, Д. Дальтон разработал простой способ определения относительных масс атомов. Он предложил за единицу массы атомов принять массу одного атома водорода. Массу атома любого другого элемента можно найти, сравнив массу водорода с массой вещества, вступившего в химическую реакцию соединения этого элемента с водородом.
В качестве единичной атомной массы mатпринимается 1/12 массы атома ядра изотопа углерода 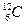 :
:
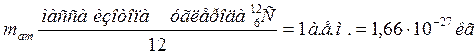 (10.2)
(10.2)
Относительная молекулярная масса, или относительная масса молекулы, есть отношение массы молекулы к единичной атомной массе:
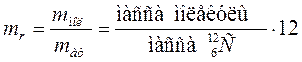 (10.3)
(10.3)
Аналогично определяют и относительную атомную массу.
Абсолютные значения атомных масс по порядку величины заключаются в пределах 10 –25 ÷ 10 –27 кг, а относительные атомные массы в пределах 1÷102. Пределы относительных молекулярных масс mr от 1 до 105.
Количество вещества. Количество вещества характеризуется числом его структурных элементов. В СИ оно выражается в молях. Моль является основной единицей измерения, так же как метр и секунда.
Мольравен количеству вещества рассматриваемой системы, которое содержит столько же структурных элементов, сколько атомов содержится в 0,012 кг изотопа углерода 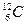 .
.
Понятие моля относится к числу структурных элементов вещества. Поэтому нужно говорить: «моль молекул», «моль атомов», «моль электронов» и т.п.
Таким образом, моль любого вещества содержит одинаковое число структурных элементов. Это число называется постоянной Авогадро или числом Авогадро:
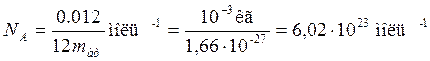 (10.4)
(10.4)
Отсюда следует:
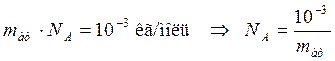 (10.5)
(10.5)
Молярная масса –масса одного моля молекул вещества:
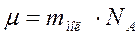
Её определяют через относительную массу молекулы:
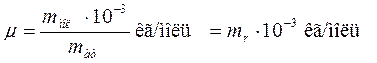 (10.6)
(10.6)
Число молей молекул n связано с числом молекул N некоторого вещества формулой:
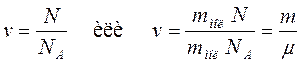 , (10.6)
, (10.6)
где 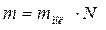 – масса вещества.
– масса вещества.
Дата добавления: 2017-01-08; просмотров: 2447;











