Химические свойства аминокислот.
1. Горение:
4NH2CH2COOH + 13O2 → 8CO2 + 10H2O + 2N2
2. Взаимодействие с водой:
NH2CH2COOH + H2O  +NH3CH2COOH + OH−
+NH3CH2COOH + OH−
NH2CH2COOH + H2O  NH2CH2COO−+ H3O+
NH2CH2COO−+ H3O+
(NH2CH2COOH  NH2CH2COO− + H+)
NH2CH2COO− + H+)
Т.е. кислотно-основные превращение можно представить в виде:
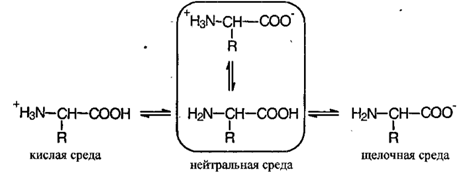
Аминокислоты - амфотерные органические вещества. В водных растворах большинства аминокислот среда слабокислотная.
Так как аминокислоты в водных растворах ведут себя как типичные амфотерные соединения, то в живых организмах они играют роль буферных веществ, поддерживающих определенную концентрацию ионов водорода.
3. Группа −СООН (карбоксильная группа) определяет кислотные свойства этих соединений. Реакции с растворами щелочей:
NH2CH2COOH + NaOH → NH2CH2COO−Na + H2O
аминоацетат натрия
4. Реагируют как кислоты со спиртами в присутствие газообразного HCl (реакция этерификация):
NH2CH2COOH + C2H5OH → NH2CH2COOC2H5 + H2O
5. Аминогруппа —NН2 определяет основные свойства аминокислот, так как способна присоединять к себе катион водорода по донорно-акцепторному механизму за счет наличия свободной электронной пары у атома азота. Реакции с растворами кислот
2NH2CH2COOH + H2SO4 → (NH3CH2COOH)2SO4
сульфат глициния
6. Конденсация:
а) димеризация
NH2−(CH2)5−COOH + H−NH−(CH2)5−COOH →H2N−(CH2)5−CO−NH−(CH2)5−COOH+H2O
аминокапроновая (6-аминогексановая) кислота димер (дипептид)
б) поликонденсация
nNH2−(CH2)5−COOH → [−NH−(CH2)5−COO−]n + (n − 1)H2O
аминокапроновая кислота капрон
Группа −CO−NH− называется амидной группой (пептидная группа, связь (−C−N−) − пептидной связью, а образующиеся полимеры – полиамидами (полимеры α−аминокислот − полипептидами). В зависимости от числа остатков аминокислот различают дипептиды, трипептиды, полипептиды.
К полипептидам относятся белки. При гидролизе белков (в кислотной среде или под действием ферментов) образуется смесь α−аминокислот.
Дата добавления: 2017-06-13; просмотров: 2843;











