Химическое равновесие
Цели
формирование у студентов представлений о факторах, влияющих на смещение равновесия биохимических процессов.
Исходные знания студентов:
Закон действующих масс. Принцип Ле-Шателье.
Студент должен знать: понятие «химическое равновесие». Термодинамические условия химического равновесия в изолированных и закрытых системах. Константа химического равновесия. Уравнения изотермы и изобары химических реакций.
Студент должен уметь:прогнозировать результаты физико-химических процессов, протекающих в живых системах, опираясь на теоретически положения, в зависимости от изменения температуры и давления (расчеты по уравнениям изотермы и изобары химической реакции).
Приложение 1: Краткий теоретический материал
Химическое равновесие – это такое состояние системы, при котором скорости прямой и обратной реакций равны между собой.
В равновесии изменения изобарно-изотермического потенциала (∆G) и изохорно-изотермического потенциала (∆F) равны нулю.
Закон действующих масс:
скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях их стехиометрических коэффициентов.
aA + bB ↔сС + dD 



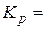
 (РDd ·PCc) /( РAa ·PBb)
(РDd ·PCc) /( РAa ·PBb)
а, b, c, d - стехиометрические коэффициенты
Константа равновесия может быть выражена не только через парциальные давления газообразных участников реакции, но и через молярные концентрации и мольные доли исходных веществ и продуктов реакции.
КР= КС (RT)∆n= Кχ (Pобщ) ∆n
КС – константа равновесия, выраженная через концентрации участников реакции
R- газовая постоянная, R=8,314 Дж/(моль К)
∆n-разность количеств вещества конечных и исходных газообразных участников реакции
Кχ– константа равновесия, выраженная через мольные доли участников реакции
Робщ – общее давление.
Направление химической реакции определяют по величине изобарно-изотермического потенциала:
ΔG<0 - протекает прямая реакция; самопроизвольный процесс;
ΔG=0, система находится в состоянии равновесия;
ΔG>0, протекает обратная реакция; несамопроизвольный процесс.
Рассчитывают ΔG по уравнению изотермы химической реакции:
ΔGх.р. = - RT ln Kp + RT ln (РDd ·PCc / РAa ·PBb)
R- газовая постоянная, R=8,314 Дж/(моль К).
Kp–константа равновесия
РD, РС - неравновесные давления газообразных продуктов реакции
РА , РB- неравновесные давления газообразных исходных веществ.
- RT ln Kp= ΔG0298, х.р.
Способы расчёта изобарно-изотермического потенциала:
1) 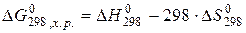
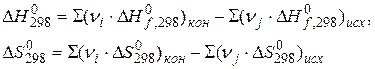
2) 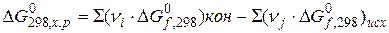
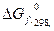 - стандартное изменение энергии Гиббса при образовании 1 моля вещества из простых веществ (справочные данные).
- стандартное изменение энергии Гиббса при образовании 1 моля вещества из простых веществ (справочные данные).
Принцип Ле- Шателье:
если на систему, находящуюся в состоянии равновесия подействовать извне, то система смещает равновесие в сторону противодействия внешнему воздействию.
Повышение температуры смещает равновесие в сторону протекания эндотермического процесса. Повышение давления - в сторону образования меньшего числа моль газообразных веществ.
Зависимость константы химического равновесия от температуры при постоянном давлении описывает уравнение изобары Вант-Гоффа:
дифференциальная форма уравнения изобары
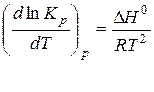 ,
,
где R- газовая постоянная, R=8,314 Дж/(моль К);
Kp– константа равновесия, выраженная через давления;
Т – температура;
∆Н – тепловой эффект реакции.
интегральная форма уравнения изобары
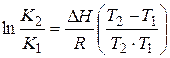
К1, К2 –константы химического равновесия реакции при температурах Т1 и Т2.
Зависимость константы химического равновесия от давления описывает уравнение Планка – Ван – Лаара:
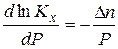
Кх – константа химического равновесия, выраженная через мольные доли;
Р – давление;
∆n – изменение числа моль газообразных участников реакции.
Приложение 2: Вопросы для самоконтроля
1) Что называют химическим равновесием?
2) Какие реакции называют обратимыми по направлению реакции?
3) Какие реакции называют необратимыми по направлению реакции?
4) Назовите термодинамические условия равновесия в изолированных и закрытых системах.
5) Какими способами рассчитывают ∆G? Приведите расчётные формулы.
6) Через какие характеристики системы можно выразить константу равновесия?
7) Запишите уравнение изотермы и изобары химической реакции.
Приложение 3: Тренировочный тест
1. В системе 2SО2 + O2 —> 2SO3 исходные концентрации SО2 и О2 были соответственно равны 0,03 и 0,015 моль/л. В момент равновесия [SО2] стала равной 0,01моль/л. Константа равновесия равна
а) 180
б)260
в) 525
г) 800
2. При 508°С константа скорости реакции Н2(г) + J2(г) —>2HJ(г) равна
0,16 л/(моль·мин). Исходные концентрации Н2 и J2 соответственно равны 0,04 и 0,05 моль/ л. Начальная скорость реакции составляет_________ моль/( л·мин).
а) 3,2·10-4
б) 1,92·10-4
в) 9,6 ·10-5
г) 2,8 ·10-5
3. В системе 2SО2(г) + O2(г) —> 2SO3(г) исходные концентрации SО2 и О2 были соответственно равны 0,03 и 0,015 моль/л. В момент равновесия [SО2] стала равной 0,01, а равновесная [SО3] _____моль/ л
а) 0,005
б) 0,01
в) 0,02
г) 0,05
4. Если в системе 2Са(к) + О2(г) —> 2СаО(к) увеличить давление в 2 раза, то скорость прямой реакции
а) возрастет в 4 раза
б) возрастет в 2 раза
в) понизится в 2 раза
г) не изменится
5. Исходная концентрация СО и Сl2 в системе СО + Сl2 —>СОСl2 были равны 0,3 и 0,2 моль/л. Если концентрацию СО повысить до 0,6, а Сl2 до 1,2 моль/л, то скорость реакции между ними увеличится в
а) 2 раза
б) 6 раз
в)12 раз
г) 24 раза
Эталоны ответов к тесту: 1а, 2а, 3а, 4б, 5в
Приложение 4: Ситуационные задачи.
1)Константа равновесия системы СО2(г) + Н2(г) —> CO(г) + Н2О(г) равна 1. В начальный момент [СО2] и [Н2] были соответственно равны 0,2 и 0,8 моль/ дм3. Концентрация [СО] равн. Составляет ______(моль/ дм3)
2)Запишите выражения КР для реакций:
1. CO + H2 = С граф +H2O газ
2. 2CI2 + 2H2O газ = 4HCI(г) + О2
Как связаны КР и КС для этих реакций?
3) Железо и водяной пар реагируют по уравнению:
Fe тв + H2O газ = FeО тв + H2 газ. При температуре 1298К и Робщ = 1атм равновесие наблюдается при РH2 = 0, 562 атм. и Р H2O = 0,438 атм. При температуре 1173К равновесие наблюдается при Р(H2)=
0,592 атм., Р (H2O) = 0,408 атм. Рассчитайте средний тепловой эффект реакции в этом интервале температур.
4) При 1000К для реакции SO2 + NO2 = SO3 +NO; Кр = 7,6. В каком направлении будет протекать реакция при РSO2 = 1 атм.; PNO2 = 6 атм.; PSO3 = 2 атм.; PNO= 3 атм.
5) Напишите уравнение, описывающее влияние давления на химическое равновесие. Приведите примеры реакций, на равновесие которых влияет давление и не влияет.
6) Как влияет общее давление на равновесие:
FeCO3 кр = FeO кр + CO2?
7) Для реакции N2+3H2 = 2NH3 при 6230К КР = 7,23 · 10 -14 (Н/м2)-2. В каком направлении будет протекать процесс при:
РN2 = PH2 = PNH3 = 1,0132 · 105 Н/м2.
8) Как нужно изменить условия проведения реакции (Т и Р)
CO + H2O(газ) = CO2 +H2, чтобы сдвинуть равновесие в сторону продуктов, если ΔН0800К = -36994 Дж/моль.
9). Для реакции: 2CO + 2H2 = CH4 + CO2 при 1000К КР = 2,57 · 10-8 (Н/м)-2. Определить, в каком направлении будет протекать реакция, если:
РСО = 1,0132 · 104;
РН2 = 2, 0264 · 104;
РСН4 = 2, 0264 · 104;
РСО2 = 6, 0792 · 104 Н/м2
10). Для реакции СТВ + 2Н2 Г = СН4 г, при 973К КР = 0, 1924 · 10-5 Н/м2, а при 1033К КР = 0,1159 · 10-5. Вычислить средний тепловой эффект реакции в этом интервале температур.
11)Что требуется сделать для для смещения равновесия гомогенной химической реакции 2НI ® 2H2 + O2, ΔH < 0, в сторону продуктов?
12)Как увеличить выход продуктов реакции
2Pb(NO3)2 (тв) « 2 PbO(тв)+4 NO2(г)+О2 (г), ΔH > 0.
13)Запишите уравнение константы равновесия гетерогенной химической реакции 2H2S(г) + SO2 (г) « 2S(к) + 2H2O(г)К = [H2O]2 / [H2S]2 · [SO2]Лабораторная работа
Влияние изменения концентраций на химическое равновесие.
Воздействие концентраций на равновесие изучим на примере реакции хлорида железа (+3) с роданидом калия. м.
Обычно полное уравнение реакции представляют так:

 FeCl3 + 3KSCN
FeCl3 + 3KSCN  Fe(SCN)3 + 3KCl.
Fe(SCN)3 + 3KCl.
Этому молекулярному уравнению можно сопоставить разные ионные.
Если считать, что хлорид железа полностью распадается на ионы, а роданид железа совсем не распадается, получается следующее сокращённое ионное уравнение:
 Fe3+ + 3SCN–
Fe3+ + 3SCN–  Fe(SCN)3.
Fe(SCN)3.
Частичной диссоциации обеих солей железа отвечают другие ионные уравнения, например, такое:

 FeCl2+ + 2SCN–
FeCl2+ + 2SCN–  Fe(SCN)2+ + Cl–.
Fe(SCN)2+ + Cl–.
Запишите стандартное выражение для константы данного равновесия.
В пробирку налейте 10 мл раствора KSCN и прибавьте 1–2 капли разбавленного раствора FeCl3. Должен получиться слабоокрашенный раствор. Его разделите на 4 равные порции.
К первой порции прибавьте концентрированный раствор FeCl3. Во вторую порцию всыпьте ложечку сухого KSCN. К третьей порции добавьте ложечку сухого KCl или влейте 1–2 мл концентрированной HСl. Четвёртая пробирка предназначена для сравнения (исходное состояние).
Единственным ярко окрашенным веществом в системе является соединение ионов железа и роданида.
Проанализируйте изменения цвета в порциях 1-3 с точки зрения принципа Ле-Шателье. Какой из вариантов ионного уравнения противоречит опыту?
Сделайте выводы о проделанной работе.
КОЛЛИГАТИВНЫЕ СВОЙСТВА РАСТВОРОВ
(Раздел написан С.Б. Орловым)
- Цель занятия:
Изучение коллигативных свойств растворов
- Студент должен знать:
Коллигативные свойства разбавленных растворов не электролитов. Закон Рауля и следствия из него. Осмотическое давление: закон Вант-Гоффа.
Студент должен уметь: решать задачи, определять осмотическое давление раствора
Изменения термодинамических свойств растворов относительно свойств растворителя зависят от: понижения давления пара, повышения температуры кипения, понижения температуры замерзания и осмотического давления. Поскольку такие свойства обусловлены коллективным влиянием растворённых частиц, их принято называть коллигативными – от латинского colligatus, что означает собирать.
Разберем этот вопрос подробнее.
При внесении в растворитель некоторого вещества меняются термодинамические свойства не только растворяемого вещества, но и свойства растворителя. Эти изменения связаны с характером взаимодействия молекул вещества и растворителя, а также с уменьшением концентрации молекул растворителя и пропорциональны числу растворенных частиц. Поэтому для свойств растворителя удобно использовать понятие идеального раствора.
Идеальным раствором называется раствор, образование которого не сопровождается химическим взаимодействием, изменением объёма и тепловым эффектом (∆Нсмеш. = 0).
Французский ученый Ф. М. Рауль первый сформулировал законы, описывающие влияние растворенного вещества на физические свойства растворителя. Эти законы выведены на основе второго начала термодинамики из условия термодинамического равновесия ∆ G = 0 для физических процессов.
Например, если в замкнутый сосуд поместить чистый растворитель, можно воду, то в этой системе будут протекать два процесса: испарение молекул воды с поверхности жидкости и обратный процесс – конденсация молекул из газовой фазы на поверхности жидкости. Через некоторое время в системе установится динамическое равновесие ∆ G = 0, т.е. такое состояние системы, когда число частиц, испаряющихся с поверхности жидкости за единицу времени, равно числу частиц, переходящих в жидкость из газовой фазы.
Пар, находящийся в равновесии с жидкостью, называют насыщенным. Давление такого пара р0называют давлением или упругостью насыщенного пара чистого растворителя.
При данной температуре давление насыщенного пара чистого растворителя – величина постоянная и является термодинамической характеристикой растворителя. При повышении температуры р0 над растворителем возрастает в соответствии с принципом Ле Шателье, так как испарение – процесс эндотермический. (∆Ниспар. => 0).
Если в летучий растворитель (спирт, вода и т. д.) внести нелетучее растворимое вещество, например сахарозу или хлористый натрий, то концентрация растворителя в образовавшемся растворе уменьшится, а следовательно, уменьшится число частиц растворителя, переходящих в газовую фазу, соответственно уменьшится химический потенциал растворителя. При этом давление насыщенного пара над раствором нелетучего вещества станет меньше, чем над чистым растворителем, следовательно, чем более концентрированный раствор, тем ниже давление пара растворителя над раствором. Эти эксперименты позволили Раулю в 1886 г. сформулировать первый закон:
Дата добавления: 2021-09-07; просмотров: 594;











