Лекция 6, 7. Кинетика и механизм глубокого окисления сульфидов железа, цинка и меди при высоких температурах.
План лекции:
1. Окисление сульфидов металлов
2. Поведение железа в зоне окисления
3. Зона окисления никель-кобальтовых месторождений.
4.Зона окисления молибденовых и медных месторождений.
5. Зона окисления оловорудных и ртутных месторождений.
В общем виде окисление сульфидов кислородом газовой фазы может быть выражено следующими основными уравнениями:
2MeS + 3O2 = 2MeO + 2SO2 (1)
MeS + 2O2 = MeSO4 (2)
MeS + O2 = Me + SO2 (3)
О конечном результате окисления сульфидов можно судить по убыли энергии Гиббса реакций.
Сульфиды металлов могут окисляться в зависимости от температуры по различным схемам: при низких температурах – до сульфатов, при температурах обжига (700–800ОС) – до оксидов. При более высоких температурах окисление сульфидов может приводить также к образованию металла.
Термическая нестойкость сложных сульфидов приводит к тому, что в условиях окислительной атмосферы процессы окисления сводятся в основном к окислению простых сульфидов в соответствии с реакцией (1).
Оценка вероятности и преимущественно окисления тех или иных сульфидов может быть сделана на основе данных термодинамического анализа реакций окисления.
В ходе плавки устанавливается следующий порядок окисления сульфидов: сначала будут окисляться сульфиды железа, цинка и кобальта, а затем сульфиды свинца, никеля и меди. Такой порядок окисления справедлив для отдельных сульфидов и в основном сохраняется как при окислении твердых, так и расплавленных сульфидов.
Указанный порядок окисления сохраняется и при совместном окислении, хотя это не исключает полного окисления сульфидов всех металлов. Для развития зоны окисления сульфидных и других эндогенных месторождений имеют значение климат, геоморфологические условия, состав руд и свойства вмещающих пород. Наиболее интенсивно сульфидные руды окисляются в условиях влажного тропического климата, менее интенсивно – в умеренном климате, очень слабо – в сухих пустынных и высокогорных полярных областях. В условиях сглаженного рельефа окисление происходит интенсивнее, чем при резком расчлененном рельефе. Состав руд и боковых пород, их проницаемость для поверхностных вод, структура месторождений и условия залегания рудных тел – важные факторы развития зоны окисления. Трещиноватые и пористые руды окисляются более интенсивно. Наличие в окисляющихся рудах пирита приводит к образованию серной кислоты, которая способствует разрушению других сульфидов. Расположение рудных тел в зонах контактов различных пород облегчает развитие процессов окисления; наоборот, залегание рудного тела под водонепроницаемыми породами, препятствующими доступу вод к рудному телу, может затруднить развитие зоны окисления.
Основные агенты окисления рудных месторождений – поверхностная вода, кислород, углекислота, серная кислота. При этом главное действие на руду оказывает не столько сама вода, сколько растворенные в ней свободный кислород и кислоты.
Вследствие просачивания поверхностных вод, изменения их химического состава и постепенного развития процессов окисления и выщелачивания строение зоны окисления на всю ее глубину оказывается неоднородным. В области циркуляции поверхностных вод выделяются три зоны: просачивания, активного водообмена и застойных вод. Зоне просачивания соответствует измененная часть рудных тел, зоне застойных вод – неизмененная часть рудных тел, в зоне водообмена в телах неизмененных полезных ископаемых обычно встречаются измененные участки, а также скопления вторичною переотложенною материала (см. рис. 1).
В зоне окисления выделяются четыре подзоны: поверхностный слой, подзона окисленных руд, подзона окисленных выщелоченных руд и подзона богатых окисленных руд. Нижняя граница зоны окисления обычно неровная и часто не совпадает с уровнем грунтовых вод в связи с его колебаниями. В зоне окисления вес сульфиды неустойчивы и превращаются в сульфаты. При этом растворимые сульфаты выносятся. Ниже зоны окисления образуется зона вторичного обогащения или цементации.
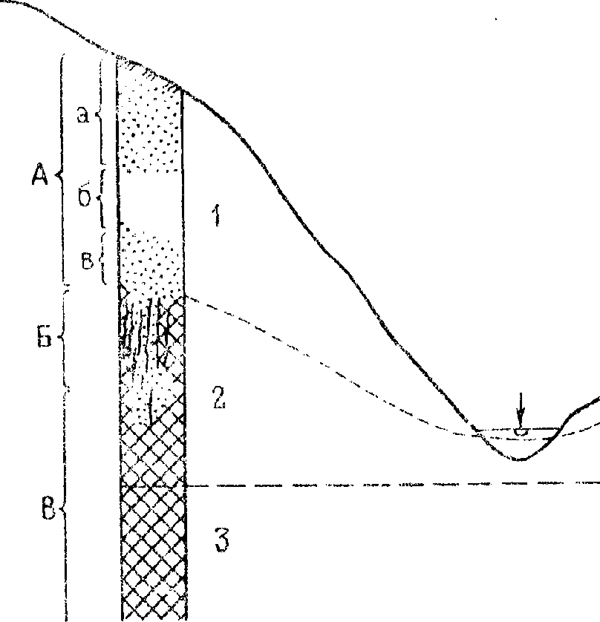
Рис. 1. Схема соотношения измененной части рудного тела и зон циркуляции приповерхностных вод среди пород равной проницаемости (разрез поперек речной долины).
Гидродинамические зоны: 1 – просачивания (аэрации). 2 – водообмена, 3 – застойных вод.
Рудные зоны: А окисления, Б – вторичного обогащения, В – первичных руд. Подзоны: а – окисленных руд. б – выщелоченных руд, в – богатых окисленных руд.
Некоторые металлы (медь, серебро, уран) выносятся из зоны окисления руд и переотлагаются в зоне цементации. Формирование этой зоны связано с недостатком в ней кислорода, в связи, с чем создаются восстановительные условия и из сульфатных растворов при отсутствии свободного кислорода выпадают такие минералы, как халькозин, ковеллин. аргентит, регенерированные урановые черни и другие. Образующиеся вторичные сульфиды и другие минералы обогащают данную зону и как бы «цементируют» первичные образования. Поэтому эта зона и называется зоной цементации. Глубина распространения зоны вторичного обобщения значительна и на некоторых месторождениях достигает 400 500 м от поверхности. Зона вторичного обогащения имеет важное промышленное значение на штокверковых медно-порфировых месторождениях.
Зона окисления сульфидных залежей развивается постепенно, в несколько стадий. В начальной стадии первичные минералы только начинают изменяться. Новообразований бывает – мало и они представлены главным образом сульфатами, частично оксидами и гидроксидами. На средней стадии окисления вторичные минералы преобладают над первичными, но в рудах сохраняются наиболее устойчивые сульфиды.
В окисленном материале преобладают оксиды, карбонаты, силикаты. На конечной стадии все сульфиды (кроме киновари) исчезают, а количество сульфатов становится незначительным. Весь материал зоны окисления сложен конечными продуктами разложения.
В окисленных рудах возникают псевдоморфные текстуры (массивные, пятнистые, полосчатые, вкрапленные, прожилковые), каркасные (ящичные, губчатые), остаточные (землистые, шлаковидные, брекчиевые), переотложенные (колломорфные, корковые, полосчатые, натечные, рыхлые). В поверхностной зоне над сульфидными залежами возникают отрицательные формы рельефа. Детальное изучение окисленных руд (остаточных первичных минералов, каркасных текстур и др.) необходимо для оценки оруденения, скрытого на глубине.
Поведение железа в зоне окисления. В сульфидных рудах основными минералами железа являются пирит, марказит, пирротин. Окисление пирита и марказита происходит по следующей схеме:
2 FeS 2 + 7О2 + H 2 O → >2 FeSO 4 + 2 H 2 SO 4 ;
12FeSO4 +6H2O + 3O2 →4Fe2(SO4)3 +4Fe(OH)3,
В дальнейшем сульфат Fe3+ в слабокислых или нейтральных растворах гидролизуется, переходит в гидроксид железа в виде гелей и дает начало образованию гидроксидов железа:
3Fe2 (SO4)3 + 6H2O « Fe (OH)3 + 3H2SO4.
4 Fe ( OH )3 = 3 Fe 2 O 3 × 3 H 2 O + 3 H 2 O
В. В. Щербина приводит для железа такую последовательность минеральных превращений:
пирит → мелантерит → фибросферрит → ярозит → лимонит (2 Fe 2 О3 × 3 H 2 O ).
В результате окисления верхние части колчеданных залежей превращаются в железные шляпы.
Образующийся при окислении пирита сульфат Fe3+ в свою очередь оказывает воздействие на пирит, что приводит к выделению серы:
FeS2 + Fe2(SO4)3 = 3F е SO4 + 2S.
За счет окисления серы образуется серная кислота или SO2. Пирротин является наиболее легко разлагаемым сульфидом FeS + 2 O 2 = FeSO 4 плюс небольшое количество свободной серной кислоты. Закисный сульфат железа FeSO4 в дальнейшем претерпевает изменение до Fe2(SO4)3, а последний, гидролизуясь, дает гидроксид железа и серную кислоту, т. е. процесс протекает аналогично окислению пирита.
В некоторых условиях пирротин подвергается дисульфидизации, т. е. замещается мельниковитом, марказитом, реже пиритом. Этот процесс происходит в том случае, когда при окислении пирротина образуется достаточное количество H2S.
Окисление халькопирита и борнита протекает аналогично пириту.
При окислении арсенопирита образуется скородит:
2 FeAsS + 6Н2О + 7 O 2 = 2[ FeAsO 4 × 2Н2О] + H 2 SO 4 .
Карбонаты железа в зоне окисления легко разрушаются. Окисление сидерита происходит по следующей реакции:
4 FeCO 3 + 6Н2О + О2 = 4 Fe ( OH ) + 4 CO 2.
В результате окисления сидеритовых рудных залежей образуются настоящие железные шляпы.
Гематит в зоне окисления, как правило, устойчив. Но при наличии в рудах обильного окисляющегося пирита гематит может превращаться в гидроксиды железа.
Магнетит также устойчив в зоне окисления. Однако нередко наблюдается его мартитизация (замещение гематитом), а при наличии пирита он превращается в гидроксиды.
Таким образом, превращение минералов железа в зоне окисления можно представить в следующем виде: железосодержащий сульфид (или другой минерал) → FeSO 4 → Fe 2 ( SO 4 )3 → Fe ( OH )3 → лимонит.
Сульфаты железа легко растворимы в воде и выносятся из зоны окисления. Часть железа может мигрировать также в виде гидрозоля Fe(OH)3. При определенных условиях может осуществляться почти полный вынос железа из зоны окисления. Однако очень часто железо в значительных количествах сохраняется в зоне окисления в виде гидроксидов, ярозита, скородита и других минералов.
Зона окисления никель-кобальтовых месторождений. Наиболее распространенными первичными минералами никеля и кобальта являются сульфиды (пентландит (Ni, Fe)9S8, миллерит NiS, линнеит Со3S4, карролит Cu(Co,Ni)2S4 и др.), сульфоарсениды (кобальтин CoAsS, гла-укодот (Со, Fe)AsS, герсдорфит NiAsS) и арсениды (никелин NiAs, шмальтин (Со, Ni)As3-2, хлоантит (Ni. Co)As3-2, саффлорит (Co. Fe)As2, раммельсбергит NiAs2 и др.).
Вес перечисленные минералы в зоне гипергенеза неустойчивы и разрушаются. При окислении судьфидов образуются сульфаты (NiSO, CoSO, FeSO, CuSO), которые хорошо растворимы, что в определенных условиях может привести к полному выносу металлов при сохранеии лишь небольших количеств гидроксидов железа. Однако следует заметить, что зона окисления месторождения кобальтоносных медистых песчаников Центральной Африки богата сферокобальтитом СоСО3 и асболаном k МпО * МпО2 m СоО п H2О, которые имеют промышленное значение.
Более сложным является окисление сульфоарсенидных и арсенидных руд никеля и кобальта. В результате окисления возникают разнообразные вторичные минералы. Наиболее распространенными являются арсенаты никеля (аннабергит Ni3(AsO4)2 8H2O) и кобальта эритрин Со3(AsO4)2*8Н2O). Минералогия окисленных Ni-Co-арсенидных руд детально изучена на месторождении Хову-Аксы (Тува), где установлена следующая последовательность образования гипергенных минералов: сульфаты → арсенаты → карбонаты → гидроксицы. Главными минералами, в которых фиксируется кобальт, являются эритрин, гетерогенит 2СоО3 n Н2О и асболан. Реже встречаются сферокобальтит, биберит CoSO4 * 7Н2O, розелит Ca2Co[AsO4]2 * 2Н2О.
Таким образом, при окислений сульфидных руд никель и кобальт могут мигрировать и рассеиваться, а при окислении арсенидных руд они остаются в зоне окисления преимущественно в виде арсенатов и некоторых других минералов.
Зона окисления молибденовых месторождений. Главный промышленный минерал – молибденит – в зоне окисления разлагается и замещается молибдитом и повеллитом. Молибдит образуется при разложении молибденита в кислой среде, в результате взаимодействия появляющихся при этом сульфатов железа и молибдена:
2MoS2 + 9O2 + 2H2 О = 2( МоО 2 × SO4) + 2 Н 2 SO4,
4Fe(OH)3 + 6MoO2 × SO4 + 15 H2 О « 2(Fe2O3 × 3MoO3 × 7.5H2O) + 6H2SO4
Молибдит
В условиях карбонатной среды вместо молибдита образуется повеллит:
Ca(HCO3)2 + MoO2 × SO4 « CaMo04 + H2S04 + 2CO2
Повеллит
Если в окисляющихся рудах содержится свинец, то может образоваться вульфенит:
2MoS2 × SO4 + O2 + 2PbO + 2 H2 О = 2PbMoO4 + 2 Н 2 SO4
Таким образом, при окислении молибденитовых руд молибден фиксируется во вторичных минералах. Однако описаны случаи выщелачивания и миграции молибдена из зоны окисления, которые возможны в условиях кислой среды, при отсутствии осадителей (карбонатных пород и вод), при длительном развитии процессов окисления. Такие условия имеют место в Центральном Казахстане.
Зона окисления вольфрамовых месторождений. Промышленные минералы – вольфрамит (Fe, Mn)W04, гюбнерит (Мп. Fe)WO4, фербериг FeWO4 и шеелит CaWO4. Все перечисленные минералы в зоне типергенеза устойчивы, перемещаются механическим путем и могут накапливаться в россыпях. Лишь при длительном окислении эти минералы разрушаются и покрываются коричневато-желтыми налетами тунгстита WO, × n H2O и ферритунгстита Fc2O3WO36H2O.
Зона окисления медных месторождений. Первичные сульфиды меди, обычно сопровождающиеся сульфидами железа, в зоне окисления неустойчивы, разлагаются, и возникает хорошо выраженная зола окисленных руд, особенно на медно – колчеданных и штокверковых месторождениях. Окисление халькопирита происходит по следующей схеме:
CuFeS 2 + 4О2 = CuSO 2 + FeSO 4 .
После образования сульфата окиси железа процесс окисления халькопирита ускоряется, причем часто образуется и самородная сера:
CuFeS2 + 2Fe2(SO4)3 = CuSO4 + 5FeSO4 + 2S.
Иногда окисление халькопирита протекает с образованием серной кислоты и сернистого ангидрида.
Сульфат меди хорошо растворим в воде, и медь мигрирует из зоны окисления. Однако при взаимодействии сульфата меди с жильными минералами руд и вмещающими породами образуются малахит, азурит, хризоколла и многие другие гипергенные минералы зоны окисления. И все же значительная часть меди выносится в зону водообмена, где из раствора выпадают вторичные сульфиды (халькозин, ковеллин, борнит) и возникает зона вторичного обогащения. Образование вторичных сульфидов в зоне цементации происходит по схеме:
5 CuFeS 2 + 11 CuSO4 + 8 Cu2S + 2FeSO4 + 8 H2SO4 ;
Халькозин
CuFeS2 + CuSO4 = 2CuS + FeSO4
Ковеллин
5FeS2 + 14CuSO4 + 12H2O = 7Cu2S + 5FeSO4 + 12H2SO4;
FeS + CuSO4 = CuS + FeSO4 .
Таким образом, в верхних частях меднорудных залежей возникает классическая вертикальная зональность. У поверхности располагается подзона окисленных руд. Ниже находится подзона выщелоченных руд, еще ниже – зона вторичного сульфидного обогащения, а затем первичные руды.
Зона вторичного обогащения особенно ценная в промышленном отношении оказывается на штокверковых медно-порфировых месторождениях (см. рис. 2). Содержание меди в рудах зоны вторичного обогащения в 2 – 3 раза (и более) выше, чем в бедной прожилково-вкрапленной первичной руде. Глубина распространения руд зоны обогащения на месторождениях этого типа достигает 400 – 450м и более.
Хорошо проявлена зона вторичного сульфидного обогащения и на медноколчеданных месторождениях. Так, на месторождениях Урала верхняя часть зоны окисления выражена гидроксидами железа (железная шляпа). Ниже следует подзона ярозита, затем подзона выщелачивания (баритовая и пиритовая сыпучка) небольшой мощности, под которой располагается зона вторичного сульфидного обогащения, а еще ниже первичные сульфидные руды. В зоне гиперкинеза медь обладает высокой миграционной способностью, образуются хорошо выраженные зоны окисления и вторичного сульфидного обогащения.
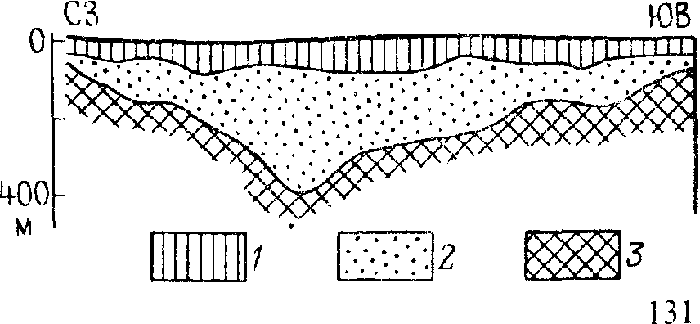
Рис. 2. Геологический разрез месторождения Коунрад:
1 – окисленные и выщелоченные руды; 2 – промышленные руды зоны вторичного сульфидного обогащения; 3 – непромышленные первичные (гидротермальные) руды
Зона окисления свинцово-цинковых месторождений. Основным минералом свинца является галенит PbS . В рудах часто, но в небольших количествах встречаются сульфосоли свинца. Главным минералом цинка является сфалерит ZnS. Оба указанных минерала в зоне гппергенеза неустойчивы и достаточно легко окисляются. При окислении галенита образуется англезит ( PbS + O 2 = PbSO 4 ), который обладает весьма малой растворимостью. Но в условиях карбонатной среды англезит неустойчив и замещается церусситом:
PbSO 4 + СО2 + Н2О = РЬСО3 + H 2 SO 4
или
2PbSO4 + Са ( НСО 3 )2 = 2 РЬСО 3 + CaSO4 + H2SO4.
Общая цепь изменения сводится к следующему: галенит → англезит → церуссит. Церуссит весьма устойчив и дает значительные скопления. Он может замещаться также пироморфитом Р b 5 С1[Р04]3, ванадинитом Р b5С1[V04]3 и другими минералами. Кроме того, в зоне окисления свинцовых месторождений встречаются плюмбоярозит PbFe 6,(OH )12[SO4]4, вульфенит Рb МоО4,. миметезит PbCl[AsO4]3, бедантит PbFe 3 ( OH )6[ SO4][ AsO4] и другие гипергенные минералы.
Таким образом, свинец в зоне окисления является малоподвижным элементом. Однако при наличии кислых растворов, характерных для начальных и средних стадий окисления колчеданно-полиметаллических руд, свинец может мигрировать и переотлагаться в виде церуссита и плюмбоярозита.
Окисление сфалерита происходит по схеме:
ZnS + 2O2 = ZnSO4 или ZnS + Ft(SO4)3 = ZnSO4 + 2FeSO4 + S.
Сульфат цинка обладает большой растворимостью и, в отличие or англезита, легко выносится. Высокая миграционная способность цинка приводит к его выносу из зоны окисления и рассеиванию, что резко отличает цинк от свинца, с которым он теснейшим образом связан в зоне первичных сульфидных руд. Особенно интенсивно выносится цинк из силикатной среды. В условиях же карбонатной среды сульфат цинка взаимодействует с карбонатами и образуется смитсонит:
МеСО3 + ZnSO 4 = ZnCO 3 MeSO 4
Скопления смитсонита часто образуются вне контуров первичною рудною тела, нередко в лежачем боку (рис. 44). Кроме смитсонита в зоне окисления полиметаллических руд образуются каламин.
Zn 4 ( OH )2( Si 2 O 7 ) – H 2 O, гидроцинкит Zn 5 ( OH )6( CO 3 )2, адамин Zn 2 ( OH )[ AsO 4 ] и др.
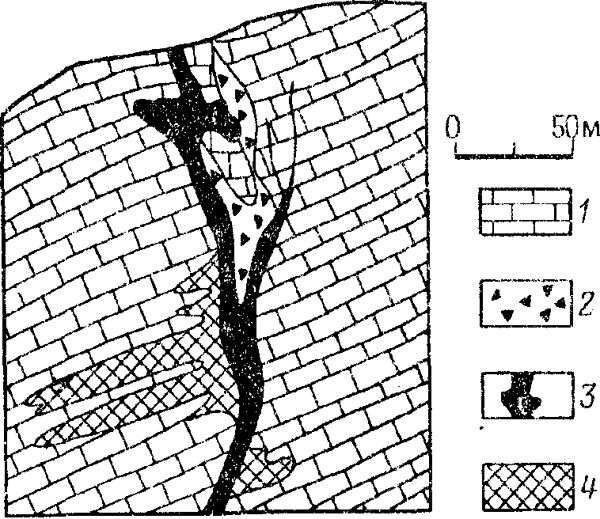
Рис. 3. Разрез, иллюстрирующий соотношение окисленных свинцовых и цинковых руд месторождения Турлан (Южный Казахстан):
1 – известняк; 2 – брекчия оседания; 3 – окисленные свинцовые рулы; 4 – окисленные цинковые рулы
Зона окисления оловорудных месторождений. Главным промышленным минералом олова является касситерит SnO2. Меньшее значение имеет станнин Cu2FeSnS4 и совсем небольшое другие сульфостаннаты: тиллит PbSnS2, франкеит Pb5Sn3Sb2S11, цилиндрит Pb3Sn4Sb2S14 и др. В зоне гипергенеза касситерит – один из самых устойчивых минералов, накапливается в россыпях, которые являются главным источником получения олова в зарубежных странах.
Сульфостаннаты в зоне окисления неустойчивы. Процесс окисления станнина можно представить в такой схеме:
2Cu2FeSnS4 + 17 О2 + 4 Н2О = 4CuSO4 + 2FcSO4 + H2SO4 – I 2H2SnO3.
Образующаяся при этом метаоловянная кислота дает коллоидный раствор, быстро коагулирующий. Возникающий гель Н28п0з при последующей дегидратации дает супергенный касситерит.
В касситерит-сульфидных рудах Н. К. Маршуковой и А. Б. Павловским выявлены и описаны такие гипергенные минералы олова, как гидростаннаты с формулой MeSn(OH)6, где Me может быть представлен двухвалентным железом, цинком, кальцием, медью и минералами группы варламовитов с широкими вариациями в их составе железа, олова и воды. Указанные гипергенные минералы олова развиваются непосредственно по станцину, что свидетельствует о слабой миграции олова в гипергенном процессе.
Зона окисления сурьмяных месторождений
Главный минерал сурьмы – антимонит, который в поверхностных условиях окисляется с образованием сульфата сурьмы: Sb2 S3 +6 O 2 = Sb 2 (SO4)3. Сульфат сурьмы весьма неустойчив и гидролизуется с образованием оксидов сурьмы сервантита Sb2O4, стибиоконита Sb2O4*H2O и в меньшей мере – валентинита Sb 2 O 4, кермезита Sb 2 S 2 O и других, дающих нередко тонкие смеси, псевдоморфно замещающие антимонит.
При окислении буланжерита Pb5Sb4S11 и тетраэдрита Cu3SbS3 образуются вторичные минералы свинца, меди и оксиды сурьмы первичные сульфидные руды.
Таким образом, в зоне гипергенеза сурьма является почти не мигрирующим элементом, так как образующиеся при окислении антимонита и других минералов вторичные оксиды и гидроксиды сурьмы обладают ничтожной растворимостью.
Зона окисления ртутных месторождений
Гланый минерал ртути – киноварь HgS – устойчив в условиях зоны окисления, перемещается механическим путем и встречается в шлихах на значительном удалении от коренных источников. При длительном окислении киноварь слабо растворяется с образованием сульфата HgS04 или хлорида HgCl2. которые неустойчивы и быстро восстанавливаются с образованием самородной ртути. Реже в зоне окисления ртутных месторождений появляется каломель HgCl и кубическая модификация киновари – метациннабарит.
Таким образом, миграция ртути в зоне гипергенеза осуществляется в основном механическим путем в виде киновари.
Поведение золота в зоне окисления золото-сульфидных месторождений. Золото в первичных рудах является самородным видимым, субмикроскопическим (невидимым), рассеянным в сульфидах, а также представлено теллуридами. В зоне гипергенеза самородное видимое золото является химически стойким, перемещается механическим путем и накапливается в россыпях. Теллуриды золота легко разлагаются, причем золото выпадает в виде тонкодисперсного коричневого порошка. Субмикроскопическое золото, освобождающееся из разлагающихся сульфидов, может растворяться (коллоидные или истинные растворы золота в виде хлоридов и сульфатов) и мигрировать как в зоне окисления, так и за ее пределы. Изучение золоторудных месторождений Урала и других районов, проведенное М. И. Альбовым, показало наличие в этих месторождениях вторичной зональности в распределении золота по вертикали. В кварц-сульфидных жилах на Урале установлен пояс вторичного золотого обогащения на глубине 20 – 150 м от поверхности. Образование этого пояса М. Н. Альбов объясняет переносом тонкодисперсного золота вниз по трещинкам рудных жил нисходящими водами.
В. М. Крейтером, В. В. Аристовым, И. С. Волынским и другими изучено поведение золота в зоне окисления медноколчеданных месторождений Урала и Центрального Казахстана.
Распределение золота в зоне окисления Майкаинского золотоколчеданно-полимсталлического месторождения представлено на рис. 4.
Высокие содержания золота в окисленных рудах возникли в связи с его растворением, миграцией в сульфатной форме и персотложением в самородном виде. Наличие самородного гипергенного золота в буром железняке, ярозите и в сыпучке подтверждается детальным микроскопическим изучением окисленных руд.
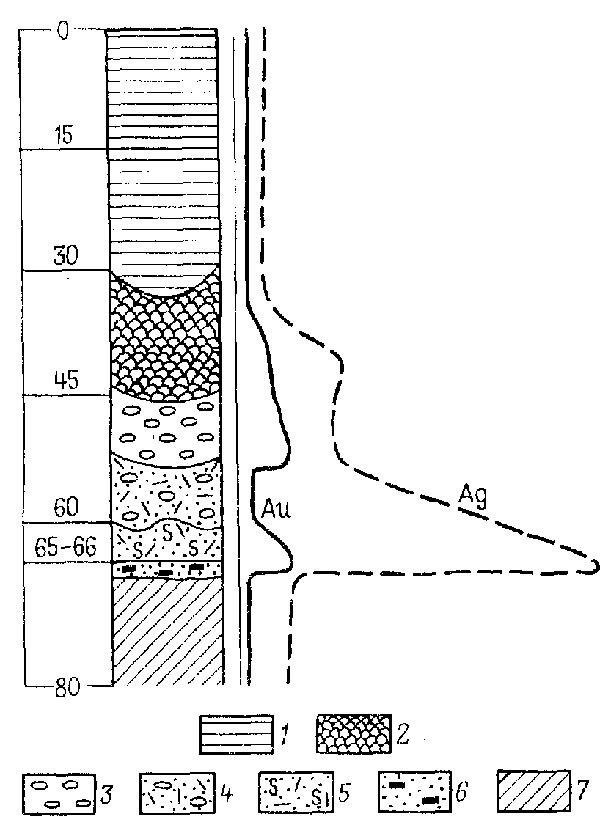
Рис. 4. Содержание золота и серебра
(в усл. сд.) в зоне окисления месторождения Майкаин (Казахстан):
1 – глины; 2 – бурые железняки; 3 – ярозиты; 4 – кварц-баритовая сыпучка с ярозитом; 5 – кварц-баритовая сыпучка с серой; 6 колчеданная сыпучка; 7 – первичные колчеданные руды
Поведение серебра в зоне окисления сульфидных месторождений. Среди гипогенных минералов серебра наиболее распространенными являются серебро самородное, аргентит Ag2S, прустит Ag3AsS3, пираргирит Ag3SbS3, теллуриды.
В зоне гипергенеза самородное серебро химически устойчиво и переносится механическим путем в россыпи. Аргентит и другие сернистые соединения серебра разлагаются с образованием Ag2S04. Этот сульфат растворим в воде и серебро мигрирует. В результате реакции Ag 2 SO4 + 2 FeSO4= = 2A g + Fe2(SO4)3, в зоне окисления образуется серебро самородное. Кроме того, в окисленных рудах часто встречаются кераргирит AgCl и другие минералы.
Миграция растворимого сульфата серебра приводит к появлению зоны вторичного обогащения, в которой отлагается вторичный аргентит:
MeS + Ag2SO4 = Ag2S + MeS04.
Глубина распространения зоны вторичного обогащения серебром на некоторых полиметаллических месторождениях может достигать нескольких сот метров.
Контрольные вопросы:
1. Объяснить процесс окисления сульфидов металлов
2. Показать поведение железа в зоне окисления
3. Объяснить зону окисления никель-кобальтовых месторождений.
4. Объяснить зону окисления молибденовых и медных месторождений.
5. Объяснить зону окисления оловорудных и ртутных месторождений.
Дата добавления: 2017-06-13; просмотров: 3925;











