Кристаллическая структура
Кристаллическая структура металлов определяется их электронной структурой. Металлы с максимальной силой межатомной связи (тугоплавкие металлы) имеют кубическую объемноцентрированную или гексагональную решетку.
Почти половина известных металлов обладает полиморфизмом. Различная кристаллическая структура модификаций полиморфного металла приводит к наличию у одного и того же металла различных физико-химических свойств. Из-за стремления к меньшей энергии высокотемпературные модификации полиморфных металлов всегда имеют более простые кристаллические решетки, чем низкотемпературные модификации. Такие решетки наиболее благоприятны для перемещения атомов относительно друг друга без нарушения связи между ними.
Е.М. Савицким сформулировано правило пластичности высокотемпературных модификаций полиморфных металлов. Согласно этому правилу высокотемпературные (ближайшие по температуре к точке плавления) модификации всех полиморфных металлов всегда имеют кристаллическую структуру объемноцентрированного или гранецентрированного куба, благодаря чему, а также полностью металлической связи между атомами, они обладают наибольшей способностью к пластической деформации, т.е. к изменению формы и размеров без разрушения.
Явление полиморфизма накладывает особенности на поведение металлов при обработке их давлением или службе в определенных условиях. Поэтому его необходимо учитывать как при выборе оптимального температурного режима пластической деформации, так и при разработке сплавов на основе полиморфных металлов. Полиморфные металлы – титан, цирконий, гафний, скандий, железо, марганец и некоторые другие – с относительно высокой точкой плавления не обладают жаропрочностью при высоких температурах, так как при температурах полиморфных переходов кристаллическая решетка металла перестраивается и резко теряет способность сопротивляться воздействию внешних усилий. Этим объясняется, что сплавы на основе мономорфного никеля работают длительное время при температурах выше 900°С, а сплавы на основе указанных, хотя и более тугоплавких, но полиморфных металлов, пригодны для работы лишь при 600…700°С.
В начале 20 века академиком Н.С. Курнаковым были установлены закономерности изменения многих физических свойств в двойных равновесных системах (законы Курнакова). Им было выяснено, что образование твердых металлических растворов сопровождается возрастанием твердости и электросопротивления по сравнению с их значениями для исходных компонентов (в тройных системах могут быть исключения), установлена зависимость твердости от состава механической смеси компонентов, показано, что металлические соединения имеют гораздо более высокие значения твердости и электросопротивления, чем образовавшие их металлы. Учение Н.С. Курнакова и работы его школы являются теоретической основой для создания новых металлических материалов с заданными свойствами.
Основным теоретическим фундаментом для выбора состава сплавов являются диаграммы состояния, которые наглядно изображают фазовое состояние сплавов в равновесных условиях в зависимости от состава и температуры. Диаграммы состояния строятся экспериментальным путем с привлечением различных методик физико-химического анализа (термический, микроструктурный, рентгенографический анализы, изменение электрофизических и механических свойств в зависимости от состава).
Основные факторы, определяющие взаимодействие металлов
В зависимости от физико-химической природы и кристаллической структуры металлов при взаимодействии между ними в двойных системах могут образовываться: а) непрерывные твердые растворы; б) ограниченные твердые растворы; в) механические смеси без твердых растворов; г) металлиды.
Все эти типы взаимодействия могут быть значительно расширены за счет рассмотрения вопросов взаимодействия в тройных и более сложных системах.
Приведенным типам взаимодействия между металлами отвечают основные типы диаграмм равновесий металлических систем. На рис. 3 приведены схематические диаграммы равновесий для случаев образования между металлами: непрерывных твердых растворов (рис. 3, а), ограниченных твердых растворов (рис. 3, б), простых эвтектических смесей без твердых растворов (рис. 3, в), устойчивых химических соединений (рис. 3, г).
По диаграммам состояния можно определить равновесное состояние и свойства сплавов в зависимости от концентрации компонентов и температуры.
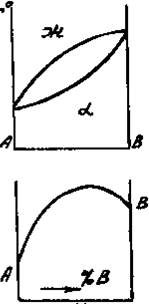
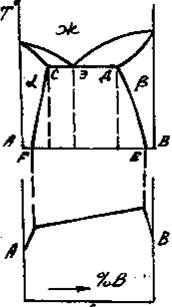
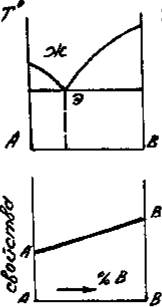
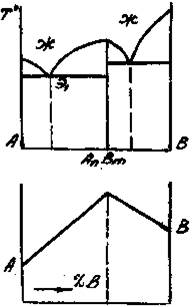
а б в г
Рис. 3. Схемы двойных систем металлов:
а — непрерывные твердые растворы; б — ограниченные твердые растворы;
в – системы с образованием простых эвтектических смесей без твердых
растворов; г – системы с образованием устойчивого химического
соединения
МЕТАЛЛУРГИЯ СПЛАВОВ
Дата добавления: 2017-05-02; просмотров: 1271;











