Размеры атомных радиусов металлов
СТРОЕНИЕ СПЛАВОВ. МЕТАЛЛОХИМИЧЕСКИЕ СВОЙСТВА ЭЛЕМЕНТОВ
Сплав – это вещество, полученное сплавлением (возможно спеканием, электролизом, возгонкой) двух или более элементов.
Если в твердом состоянии отсутствует химическое взаимодействие между элементами и они не способны к взаимному растворению, то строение сплава является механической смесью зерен обоих компонентов.
Вещества, составляющие сплав, могут вступать в химическое взаимодействие, образуя химические соединения, или взаимно растворяться друг в друге, образуя растворы. В сплавах возможно образование промежуточных фаз, которые не относятся ни к химическим соединениям, ни к растворам.
Важнейшими факторами, определяющими характер взаимодействия металлов между собой и с неметаллами, являются:
- размеры атомных радиусов металлов;
- положение металлов в ряду электроотрицательности элементов;
- валентность и ионизационный потенциал элементов.
Все эти свойства зависят от положения элементов в периодической системе. Применительно к взаимодействию металлов по определению И.И. Корнилова их называют металлохимическими свойствами элементов.
Для определения характера взаимодействия и возникающих при этом типах химической связи растворов (жидких и твердых) и соединений металлов необходимо рассматривать металлохимические свойства элементов только во взаимосвязи, а не по отдельности.
Размеры атомных радиусов металлов
Многие реакции между металлами и металлов с металлоидами отличаются от обычных химических реакций атомным характером, образованием растворов и соединений в кристаллическом состоянии с характерным типом металлической и ковалентной связи между атомами. Поэтому большое значение имеют межатомные расстояния, определяемые атомными радиусами элементов.
Каждому атому соответствует сфера действия определенного радиуса, называемая атомным радиусом, который представляет собой минимальное расстояние, на которое центры сфер одних атомов приближаются к поверхности сфер других атомов.
Атомные радиусы, как и многие другие свойства элементов, имеют строгую периодическую зависимость от атомного номера элемента. На рис. 1 представлены значения атомных радиусов элементов по группам элементов периодической системы. В этом рисунке элементы бериллий, бор и алюминий расположены во II и III группах подгруппы В, где они показывают большую последовательность изменения атомного радиуса, чем в подгруппе А.
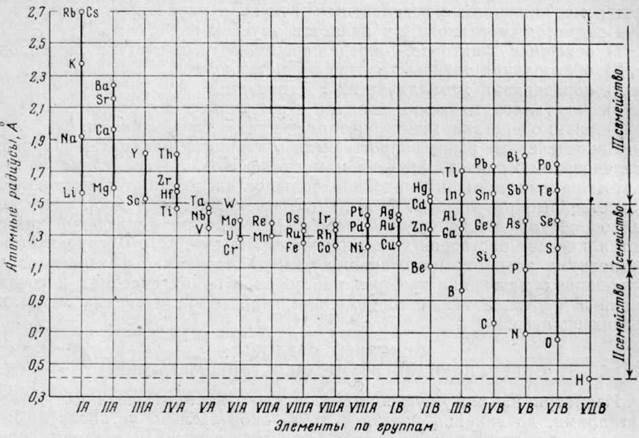
Рис. 1. Атомные радиусы элементов по группам периодической системы
По значениям атомных радиусов все элементы могут быть разделены на три семейства. Одно из них охватывает элементы со средними значениями атомных радиусов, а два других крайних семейства — элементы с максимальными и минимальными значениями этого свойства.
При рассмотрении рис. 1 можно отметить следующие характерные особенности: наибольшие значения атомных радиусов имеют металлы I и II групп подгруппы А с малыми атомными номерами, относящиеся к наиболее типичным металлам; наименьшие значения относятся к типичным легким металлоидам (B, C, N, O, Н) – элементы III-VII групп подгруппы В. Тяжелые металлы III-V групп Подгруппы В с большими атомными номерами (In, Tl, Sn, Pb, Sb, Bi) показывают увеличение размеров атомных радиусов по мере возрастания атомных номеров. Металлы, относящиеся к группе переходных элементов (III-VIII) с незаполненной d-электронной оболочкой, а также металлы I и II групп подгруппы В имеют средние значения атомных радиусов.
Последовательность изменения атомного радиуса элементов по группам заключается в уменьшении его размера по мере уменьшения атомного номера элемента данной группы.
Сходство или различие атомных радиусов элементов в связи с другими свойствами атомов имеет решающее значение для взаимодействия металлов, в частности для реакций образования соединений.
Дата добавления: 2017-05-02; просмотров: 1811;











