Электрический ток в электролитах
Первый закон Фарадея.При прохождении тока через некоторые растворы, например через раствор серной кислоты, происходит разложение воды на составные части — водород и кислород, выделяющиеся на пластинах, соединенных соответственно с отрицательным и положительным полюсами батареи. Такого рода растворы, разлагающиеся химически при прохождении через них тока, называются электролитами, а сам процесс разложения вещества электрическим током — электролизом. Проводники, погруженные в электролит для подведения к нему тока, называют электродами: положительный электрод — анодом, а отрицательный — катодом.
Продукты разложения электролита, например водород и кислород в опыте, выделяются на электродах все время, пока идет ток. Массу выделившегося вещества можно измерить. Если подобрать такой раствор, при котором выделяющееся вещество оседает в виде твердого осадка на электроде, то эту массу можно измерить без затруднений. Так, если пропускать ток через раствор медного купороса (CuS04), то на катоде оседает медь. Это явление легко наблюдать, если сделать катод, например, из угля; на черной поверхности угля ясно заметен красноватый слой выделившейся меди. Взвешивая катод до и после опыта, можно точно определить массу осадившегося металла.
Измерения показывают, что масса вещества, выделившегося на электродах, зависит от силы тока и времени электролиза. Замыкая цепь на разные промежутки времени, можно убедиться в том, что масса выделившегося вещества пропорциональна времени прохождения тока.
Масса выделившегося вещества пропорциональна и силе тока и времени электролиза, т. е. их произведению. Но это произведение, согласно формуле
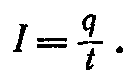
, равно заряду, прошедшему через электролит. Мы видим, что масса вещества, выделившегося на электроде, пропорциональна заряду, или количеству электричества, прошедшему через электролит. Этот важный закон был установлен впервые Фарадеем и носит название первого закона Фарадея.
 Если m— масса выделившегося вещества, I — сила тока, t — время электролиза, a q — полный заряд, прошедший через ванну (сквозь которую пропускают электрический ток), за время t, то первый закон Фарадея можно записать так;
Если m— масса выделившегося вещества, I — сила тока, t — время электролиза, a q — полный заряд, прошедший через ванну (сквозь которую пропускают электрический ток), за время t, то первый закон Фарадея можно записать так;
где К — коэффициент пропорциональности. Полагая в этой формуле заряд q=1 Кл, мы получим, что коэффициент К равен массе вещества, выделяемого зарядом 1 Кл, или иначе — массе вещества, выделяемого током 1 А за 1 с. Исследования Фарадея показали, что величина К является характерной для каждого вещества. Так, например, при электролизе раствора ляписа (азотнокислого серебра, AgNOg) 1 Кл выделяет 1,1180 мг серебра; точно столько же серебра выделяет 1 Кл при электролизе любой серебряной соли, например хлористого серебра (AgCl) и т. д. При электролизе соли другого металла масса выделившегося вещества будет иной. Величина К называется электрохимическим эквивалентом данного вещества. Таким образом, электрохимическим эквивалентом вещества называется масса этого вещества, выделяемая при электролизе одним кулоном протекшего через раствор электричества.
Второй закон Фарадея. Электрохимические эквиваленты различных веществ существенно отличны один от другого. От каких же свойств вещества зависит его электрохимический эквивалент?
Ответ на этот вопрос дает следующий важный закон, также установленный Фарадеем на опыте (второй закон Фарадея): электрохимические эквиваленты различных веществ пропорциональны их молярным массам и обратно пропорциональны числам, выражающим их химическую валентность.
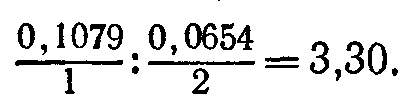 Например, молярная масса серебра равна 0,1079 кг/моль, его валентность — 1. Молярная масса цинка равна 0,0654 кг/моль, его валентность — 2. Поэтому по второму закону Фарадея электрохимические эквиваленты серебра и цинка должны относиться, как
Например, молярная масса серебра равна 0,1079 кг/моль, его валентность — 1. Молярная масса цинка равна 0,0654 кг/моль, его валентность — 2. Поэтому по второму закону Фарадея электрохимические эквиваленты серебра и цинка должны относиться, как
Экспериментальные значения электрохимических эквивалентов равны 1,118∙10-6 кг/Кл для серебра и 0,3388∙10-6 кг/Кл для цинка; их отношение равно 1,118/0,3388=3,30, что согласуется со вторым законом Фарадея.
 Если обозначить по-прежнему через К [кг/Кл] электрохимический эквивалент вещества, через М [кг/моль] — его молярную массу, а через п — валентность (я—1, 2,...), то второй закон Фарадея можно записать в виде
Если обозначить по-прежнему через К [кг/Кл] электрохимический эквивалент вещества, через М [кг/моль] — его молярную массу, а через п — валентность (я—1, 2,...), то второй закон Фарадея можно записать в виде
Здесь через 1/Fобозначен коэффициент пропорциональности, который является универсальной постоянной, т. е. имеет одинаковое значение для всех веществ. Величина F называется постоянной Фарадея. Ее значение, найденное экспериментально, равно

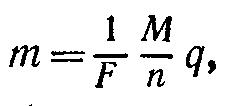 Отношение молярной массы какого-либо вещества к его валентности М/п называют химическим эквивалентом данного вещества. Это отношение показывает, какая масса данного вещества необходима для замещения одного моля водорода в химических соединениях. У одновалентных веществ химический эквивалент численно равен молярной массе. Пользуясь этим понятием, можно выразить второй закон Фарадея следующим образом: электрохимические эквиваленты веществ пропорциональны их химическим эквивалентам.
Отношение молярной массы какого-либо вещества к его валентности М/п называют химическим эквивалентом данного вещества. Это отношение показывает, какая масса данного вещества необходима для замещения одного моля водорода в химических соединениях. У одновалентных веществ химический эквивалент численно равен молярной массе. Пользуясь этим понятием, можно выразить второй закон Фарадея следующим образом: электрохимические эквиваленты веществ пропорциональны их химическим эквивалентам.
Объединив формулы , можно выразить оба закона Фарадея в виде одной формулы:
где т — масса вещества, выделяющегося при прохождении через электролит количества электричества q. Эта формула имеет простой физический смысл. Положим в ней т=М/п, т. е. возьмем массу одного химического эквивалента данного вещества. Тогда получим F=q. Это значит, что постоянная Фарадея, численно равна заряду q, который необходимо пропустить через любой электролит, чтобы выделить на электродах вещество в количестве, равном одному химическому эквиваленту.
Ионная проводимость электролитов. Сам факт разложения электролитов при прохождении через них тока показывает, что в них движение зарядов сопровождается движением атомов или групп атомов, связанных друг с другом (например, S04, N03 и т, п.); эти атомы или атомные группы представляют собой части молекулы растворенного вещества. Естественно предположить, что заряжены именно эти части молекулы в растворе и что они являются носителями электрического заряда. Их перемещение под действием сил электрического поля и представляет собой электрический ток, идущий через электролит.
Было обнаружено, что при прохождении тока через электролит выделение вещества происходит на обоих электродах. По химическому составу это разные части молекулы растворенного вещества. По количеству, если измерять его в химических эквивалентах, они равны. Знаки зарядов у них, очевидно, противоположны.
Заряженные атомы называются ионами. То же название носят заряженные молекулы или их части. Мы можем, следовательно, сказать, что проводимость электролитов является ионной, т. е. обусловлена движением в них положительных и отрицательных ионов, которые образуются из нейтральной молекулы путем распада ее на две части, заряженные равными и противоположными зарядами. Молекулы растворенного вещества, которые до растворения были электрически нейтральны, при растворении распадаются на положительные и отрицательные ионы, способные перемещаться независимо друг от друга.
Эти представления иллюстрируются рис. 106. Кружками между электродами со значками «+» и «—» схематически изображены положительные и отрицательные ионы растворенного вещества. Пока между электродами А и К не создано поле, ионы эти совершают только беспорядочное тепловое движение, как и все остальные молекулы раствора 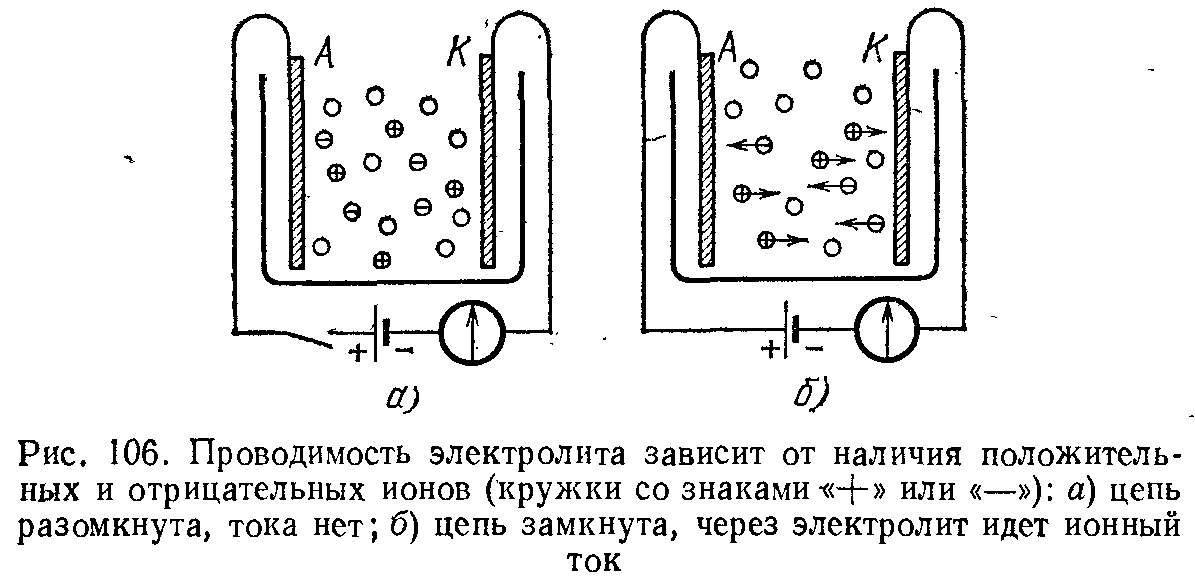 (рис. 106, а). В каждом направлении за единицу времени протекает одинаковый положительный и отрицательный заряд, т. е. нет электрического тока — преимущественного переноса заряда в определенном направлении. При наложении разности потенциалов на электроды А и K, когда внутри электролита возникает электрическое поле, на это беспорядочное движение накладывается упорядоченное движение в противоположные стороны ионов различных знаков: отрицательных — к аноду A, положительных — к катоду К (рис. 106, б).
(рис. 106, а). В каждом направлении за единицу времени протекает одинаковый положительный и отрицательный заряд, т. е. нет электрического тока — преимущественного переноса заряда в определенном направлении. При наложении разности потенциалов на электроды А и K, когда внутри электролита возникает электрическое поле, на это беспорядочное движение накладывается упорядоченное движение в противоположные стороны ионов различных знаков: отрицательных — к аноду A, положительных — к катоду К (рис. 106, б).
При соприкосновении с катодом положительные ионы получают недостающие им электроны и выделяются в виде нейтральных атомов, а взамен электронов, нейтрализовавших ионы, новые электроны переходят от батареи к катоду. Точно так же отрицательные ионы при соприкосновении с анодом отдают ему свои избыточные электроны, превращаясь в нейтральные атомы; электроны же уходят по металлическим проводам в батарею. Таким образом, ток в электролите обусловлен движущимися ионами; на электродах же происходит нейтрализация ионов и выделение их в виде нейтральных атомов (или молекул). Итак, электрический ток в электролитах представляет собой движение положительных и отрицательных ионов.
Такое представление об электролизе подкрепляется многочисленными фактами. С этой точки зрения первый закон Фарадея получает простое объяснение. Каждый осаждающийся на электроде ион переносит с собой некоторый электрический заряд. Это значит, что полный заряд, перенесенный всеми ионами, должен быть пропорционален полному числу ионов, осевших на электродах, т. е. массе выделенного вещества. А это и есть первый закон Фарадея. Так же естественно и просто объясняется с этой точки зрения и второй закон Фарадея, дающий возможность вычислить электрический заряд, связанный с каждым ионом.
Название «ион» введено Фарадеем (от греческого слова «ион» — идущий). Ионы, заряженные положительно и выделяющиеся на катоде, Фарадей назвал катионами, ионы, выделяющиеся на аноде,— анионами.
Опыт показал, что водород и металлы всегда выделяются на катоде; это значит, что в электролитах водород и металлы образуют положительные ионы.
Элементарный электрический заряд. Из формулы, объединяющей оба закона Фарадея, следует, что если заряд q численно равен постоянной Фарадея F то масса т равна М/п, т. е. при прохождении через электролит заряда, равного 96 484 Кл, выделяется М/п [кг] любого вещества, т. е. 1/п моля этого вещества. Иначе говоря, для выделения одного моля вещества через электролит должен протечь заряд, численно равный nF [Кл]. Таким образом, при выделении моля одновалентного вещества (1,008 г водорода, 22,99 г натрия, 107,87 г серебра и т. д.) через электролит проходит заряд, численно равный F=96 484 Кл; при выделении моля двухвалентного вещества (16,00 г кислорода, 65,38 г цинка, 63,55 г меди и т, д.) через электролит проходит заряд, численно равный 2F=2∙ 96 484 Кл =192 968 Кл, и т. д.
Но мы знаем, что в одном моле любого вещества содержится одно и то же число атомов, равное постоянной Авогадро NA=6,02'1023 моль-1. Таким образом, каждый, ион одновалентного вещества, выделяющийся на электроде, несет на себе заряд
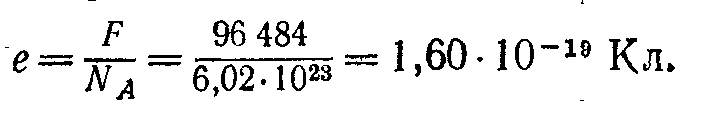
При выделении каждого атома двухвалентного вещества через электролит проходит заряд 2F/NA=3,20∙10-19 Кл, вдвое больший, и т. д. Вообще при выделении каждого атома n-валентного вещества через электролит переносится заряд nF/NA=ne [Кл].
Заряды, переносимые при электролизе с каждым ионом, представляют собой целые кратные некоторого минимального количества электричества, равного 1,6 ∙ 10-19Кл. Любой одновалентный ион (ион калия, серебра и т. д.) переносит один такой заряд. Любой двухвалентный ион (ион цинка, ртути и т. д.) переносит два таких заряда. Никогда не встречаются при электролизе случаи, когда бы с ионом переносился заряд, содержащий дробную часть от 1,6 ∙ 10-19 Кл. Немецкий физик и физиолог Герман Гельмгольц (1821—1894), обративший внимание на это следствие из закона Фарадея, сделал отсюда заключение, что указанное количество электричества 1,6 ∙ 10-19Кл представляет собой наименьшее количество электричества, существующее в природе; этот минимальный заряд получил название элементарного заряда. Одновалентные анионы (ионы хлора, йода и т. д.) несут на себе один отрицательный элементарный заряд, одновалентные катионы (ионы водорода, натрия, калия, серебра и т. д.) — один положительный элементарный заряд, двухвалентные анионы — два отрицательных элементарных заряда, двухвалентные катионы — два положительных элементарных заряда и т. д.
Таким образом, в явлениях электролиза исследователи впервые столкнулись с проявлениями дискретной (прерывистой) природы электричества и сумели определить элементарный электрический заряд. Позже были обнаружены и другие явления, в которых проявляется дискретная природа электричества, и были найдены другие способы измерения элементарного отрицательного заряда— заряда электрона. Все эти измерения дали для заряда электрона то же значение, какое мы получили только что из закона Фарадея. Это является лучшим подтверждением правильности того ионного механизма прохождения тока через электролиты.
Ионы принято обозначать знаками «+» или «—» около соответствующих формул (обычно справа вверху). Число знаков «+» или «—» равно валентности иона (например, ионы меди бывают Си+ или Си2+, ионы хлора — только С1-, и т, д.).
Электролитическая диссоциация. Представление об ионной проводимости действительно хорошо и просто объясняет явление электролиза. Откуда же берутся ионы внутри электролита, если до растворения молекулы растворенного вещества были в целом не заряжены? Возникают ли эти ионы под действием приложенного электрического поля или же они имеются внутри электролита с самого начала, еще до замыкания цепи?
Несложные опыты и рассуждения показывают, что разделение молекул на заряженные ионы не связано с наличием тока. Действительно, если бы молекулы разрывались внешним электрическим полем, то должна была бы существовать некоторая минимальная напряженность поля в электролите, необходимая для начала электролиза и зависящая от прочности молекул. Опыт же показывает, что это не так и что электролиз начинается при любом, сколь угодно малом поле. Это можно проверить, например, проводя электролиз медного купороса при медных электродах, когда нет искажающего влияния поляризации электродов, какое бывает, например, при электролизе подкисленной воды. Подобного рода опыты показывают, что ионы возникают не под действием тока, а образуются в процессе растворения вещества. Образование ионов при растворении носит название электролитической диссоциации.
Растворение не всегда сопровождается диссоциацией на ионы, а поэтому и не все растворы проводят электрический ток. Следующий опыт наглядно показывает такое различие.
 Соединим последовательно с электрической лампочкой сосуд, содержащий дистиллированную воду и два металлических электрода, и включим их в осветительную сеть. Лампочка светиться не будет, так как дистиллированная вода практически не является проводником: в ней растворено лишь ничтожное количество примесей, а сами молекулы воды почти недиссоциированы. Бросим теперь в воду щепотку сахара. Раствор по-прежнему будет оставаться непроводящим, значит, молекулы сахара при растворении не диссоциируют. Но если вместо сахара растворить в воде щепотку поваренной соли или несколько капель соляной кислоты, то лампочка начинает светиться (рис. 110): водный раствор соли проводит электричество, а следовательно, в нем происходит электролитическая диссоциация. Конечно, в этом опыте лампочка служит только индикатором тока и может быть заменена каким-нибудь измерительным прибором.
Соединим последовательно с электрической лампочкой сосуд, содержащий дистиллированную воду и два металлических электрода, и включим их в осветительную сеть. Лампочка светиться не будет, так как дистиллированная вода практически не является проводником: в ней растворено лишь ничтожное количество примесей, а сами молекулы воды почти недиссоциированы. Бросим теперь в воду щепотку сахара. Раствор по-прежнему будет оставаться непроводящим, значит, молекулы сахара при растворении не диссоциируют. Но если вместо сахара растворить в воде щепотку поваренной соли или несколько капель соляной кислоты, то лампочка начинает светиться (рис. 110): водный раствор соли проводит электричество, а следовательно, в нем происходит электролитическая диссоциация. Конечно, в этом опыте лампочка служит только индикатором тока и может быть заменена каким-нибудь измерительным прибором.
Дата добавления: 2017-05-02; просмотров: 5209;











