Градуировка амперметров при помощи электролиза.
Явление электролиза дает удобный способ измерения заряда, прошедшего через некоторый, участок цепи. Для этого достаточно включить в этот участок электролитическую ванну, например серебряную, и измерить массу выделившегося на электродах вещества. Частное от деления массы осадка на его электрохимический эквивалент будет равно заряду, прошедшему через участок цепи.
Для определения силы тока в цепи достаточно определить массу осадка на электродах и время, втечение которого этот осадок образовался. Если ток оставался за это время неизменным, то частное от деления массы осадка на время и на электрохимический эквивалент даст силу тока в цепи.
Таким образом, первый закон Фарадея позволяет свести измерения тока к измерению массы и времени, т. е. к очень простым и чрезвычайно точным операциям.
Конечно, проще всего было бы за единицу количества электричества (и за соответственную единицу силы тока) принять такое количество, которое выделяет при электролизе единицу массы какого-либо вещества, например 1 г или 1 мг серебра. Но за единицу электрического заряда принят кулон; поэтому потребовались очень тщательные и сложные опыты по установлению электрохимических эквивалентов, с помощью которых мы можем измерять путем электролиза заряд в уже выбранных единицах, кулонах, а силу тока — в амперах.
Пользуясь установленными значениями электрохимических эквивалентов, можно очень точно градуировать амперметры (гальванометры) любого устройства. Для этого достаточно соединить последовательно электролитическую ванну и амперметр, пропускать в течение известного времени неизменный ток (о чем можно судить по постоянству показаний амперметра), а затем, определить взвешиванием массу выделившегося вещества. Зная его электрохимический эквивалент, можно вычислить количество прошедшего электричества в кулонах и, разделив последнее на время опыта t, найти ток в амперах. Конечно, на практике указанным способом пользуются лишь для градуировки эталонных амперметров. Имея такие тщательно проградуированные амперметры, можно, включив их последовательно с исследуемым амперметром, проградуировать этот последний. Электролитический же способ всегда может быть применен для контроля показаний эталонного амперметра, если возникает сомнение в его исправности.
Химические и тепловые генераторы тока.
Открытие Вольты. Электрический ток может поддерживаться в цепи проводников с сопротивлением только при условии, что в цепи действует какой-либо генератор, являющийся источником э. д. с. При прохождении тока в цепи непрерывно выделяется энергия, например в виде тепла, нагревающего провода; энергия эта доставляется генератором в результате тех или иных происходящих в нем процессов, которые могут быть весьма разнообразны; в соответствии с этим весьма разнообразными могут быть и генераторы э. Д. с. В каких-то опытах использовали электрическую машину, работающую за счет энергии вращающего ее двигателя (например, мускульной энергии). Количества электричества, разделяемые такой машиной за одну секунду, весьма незначительны, и , поэтому такая машина не может обеспечить поддержание тока сколько-нибудь значительной силы.
Первым генератором э. д. с, открывшим возможность широкого изучения и практического использования электрического тока, явился гальванический элемент, в котором энергия, выделяемая в цепи тока, получается за счет энергии, освобождающейся при химических реакциях, сопровождающих работу элемента.
Такой химический генератор впервые построил итальянский физик Алессандро Вольта (1745—1827). Вольта установил, что разделение электрических зарядов (возникновение э. д. с.) происходит при соприкосновении различных проводников, в результате чего на границе соприкосновения на одном из металлов скапливаются отрицательные заряды (избыток электронов), а на другом — положительные (недостаток электронов).
 Гальванический элемент получил свое название по имени итальянского врача и анатома Луиджи Гальвани (1737—1798), опыты которого дали толчок к исследованиям Вольты. Гальвани обнаружил, что свежепрепарированная лягушечья лапка, подвешенная на медном крючке к железной перекладине, сокращалась всякий раз, когда она касалась железа (рис.113). Так как в эти времена уже было известно, что препарированная лапка лягушки сокращается при пропускании через нее электрического разряда (например, разряда лейденской банки), то Гальвани правильно приписал наблюдавшееся им явление действию разряда, но он ошибочно полагал, что электрические заряды вырабатываются вследствие каких-то жизненных процессов в лапке лягушки. Вольта, поставив физические опыты, установил, что явление связано с наличием двух различных металлов (медного крючка и железной перекладины), соприкасающихся с электролитами (жидкостью в лягушечьей лапке и слоем влаги, покрывающей в обычных условиях все металлические предметы), и что лягушечья лапка играла лишь роль чувствительного прибора, обнаруживающего наличие тока.
Гальванический элемент получил свое название по имени итальянского врача и анатома Луиджи Гальвани (1737—1798), опыты которого дали толчок к исследованиям Вольты. Гальвани обнаружил, что свежепрепарированная лягушечья лапка, подвешенная на медном крючке к железной перекладине, сокращалась всякий раз, когда она касалась железа (рис.113). Так как в эти времена уже было известно, что препарированная лапка лягушки сокращается при пропускании через нее электрического разряда (например, разряда лейденской банки), то Гальвани правильно приписал наблюдавшееся им явление действию разряда, но он ошибочно полагал, что электрические заряды вырабатываются вследствие каких-то жизненных процессов в лапке лягушки. Вольта, поставив физические опыты, установил, что явление связано с наличием двух различных металлов (медного крючка и железной перекладины), соприкасающихся с электролитами (жидкостью в лягушечьей лапке и слоем влаги, покрывающей в обычных условиях все металлические предметы), и что лягушечья лапка играла лишь роль чувствительного прибора, обнаруживающего наличие тока.

 Правило Вольты. Гальванический элемент.Явление, установленное Гальвани и Вольтой,— разделение зарядов, т. е. возникновение э. д. с. на границе соприкосновения различных проводников,— было использовано для построения гальванического элемента. Однако, как выяснил Вольта, нельзя получить гальванический элемент, если составить замкнутую цепь из одних только проводников первого рода (уголь и металлы), которые не претерпевают никаких химических изменений при прохождении тока. Это показывает следующий опыт.
Правило Вольты. Гальванический элемент.Явление, установленное Гальвани и Вольтой,— разделение зарядов, т. е. возникновение э. д. с. на границе соприкосновения различных проводников,— было использовано для построения гальванического элемента. Однако, как выяснил Вольта, нельзя получить гальванический элемент, если составить замкнутую цепь из одних только проводников первого рода (уголь и металлы), которые не претерпевают никаких химических изменений при прохождении тока. Это показывает следующий опыт.
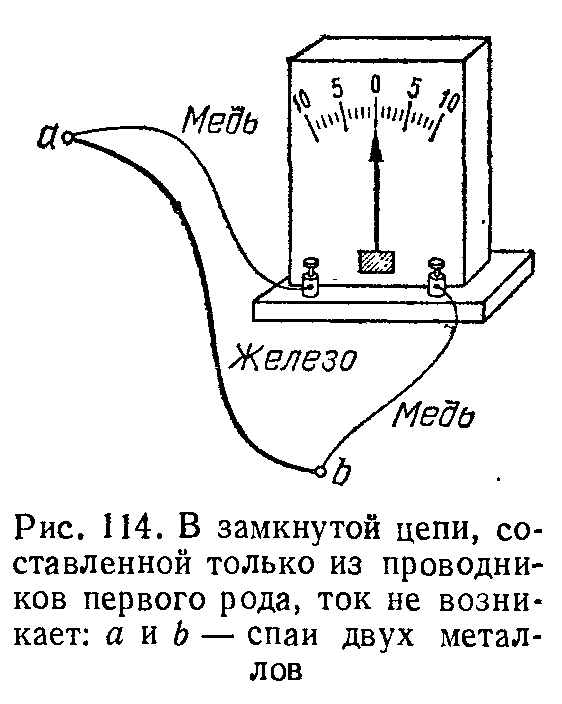
Прикрутим к концам железной проволоки по куску медной проволоки и свободные медные концы присоединим к чувствительному гальванометру (рис. 114). Мы получим замкнутую цепь, состоящую из железной, двух медных проволок и проволоки (в виде нити или катушки), представляющей собой основную часть гальванометра. Таким образом, эта цепь состоит целиком из металлов (проводников первого рода), В этих условиях даже весьма чувствительный гальванометр не обнаруживает тока. Тока не будет и в том случае, если вместо железной проволоки мы возьмем цинковую или еще какую-либо иную, если вместо скручивания мы спаяем два проводника, т. е. введем слой третьего металла — олова, или составим более сложную цепь, содержащую не два разных металла, а три, четыре и вообще любое их число. Это значит, что в цепи, состоящей из произвольного числа любых металлов, э. д. с. равна нулю (правило Вольты). Правило Вольты стоит в глубокой связи с тем обстоятельством, что металлы (проводники первого рода) не испытывают химических изменений при прохождении тока. Если бы правило Вольты не соблюдалось, то мы могли бы устроить цепь, в которой ток шел бы в течение длительного времени и совершал бы разнообразную работу, например, вращал бы мотор, без уменьшения запаса энергии этой цепи. Действительно, внутренняя энергия такой цепи не может уменьшаться, ибо вещества, ее составляющие (металлы), не изменяются. Но если внутренняя энергия цепи не уменьшается и к цепи не подводится извне тепло, то по закону сохранения энергии не может и совершаться работа, т. е. в цепи не может, поддерживаться длительный ток. Нетрудно понять, почему в замкнутой цепи из различных проводников первого рода не идет ток, т. е. э. д. с. равна нулю, хотя на границах соприкосновения отдельных проводников возникает, как мы указывали, э. д. с. В такой цепи есть несколько мест соприкосновения различных металлов, по крайней мере два или больше (рис. 115). Следовательно, в цепи возникает несколько различных э. д. с, отличающихся еще и по направлению (знаку), так что общая (результирующая) э. д. с. равна алгебраической сумме всех отдельных э. д. с. Поскольку опыт показывает, .что в такой цепи нет тока (что можно предвидеть на основании закона сохранения энергии), то, следовательно, алгебраическая сумма всех э. д. с. в замкнутой цепи, составленной из проводников первого рода, равна нулю. Однако явление меняется, если хотя бы один из участков цепи оказывается проводником второго рода. Изменение химического состава этого проводника при прохождении тока может быть началом ряда химических превращений, в результате которых внутренняя (химическая) энергия тел, составляющих цепь, будет уменьшаться, и за счет этой энергии может поддерживаться ток в цепи. Действительно, Вольта, погрузив медную и цинковую пластины в раствор серной кислоты, осуществил первый гальванический элемент, и поныне называемый элементом Вольты (рис. 116), Соединяя каким-либо проводником, например металлической проволокой, медную и цинковую пластины (электроды) элемента Вольты, мы получим в этой замкнутой цепи электрический ток.
Элемент Вольты содержит все необходимые для любого гальванического элемента части: два различных проводника первого рода (цинк и медь), соприкасающиеся с проводником второго рода (раствор серной кислоты). Но практически, этот элемент неудобен, так как э. д. с. его, вначале равная 1,1В, при работе элемента быстро падает. Поэтому на практике чаще применяют другие элементы, отличающиеся от элемента Вольты иным подбором проводников первого и второго рода.
Пластины гальванического элемента, между которыми возникает разность потенциалов, называются полюсами (или электродами). Тот полюс, у которого потенциал выше, называется положительным (или анодом), другой — отрицательным (катодом). В элементе Вольты положительным полюсом служит медь.
Часто употребляется элемент Даниеля, положительным электродом которого является медь, погруженная в медный купорос, а отрицательным — цинк, погруженный в цинковый купорос или серную кислоту. В обычной конструкции (рис. 117) электроды помещаются в стеклянный сосуд 1 цинковый электрод 4 окружен раствором ZnS04, а медный электрод 2 окружен раствором CuS04. Чтобы предохранить растворы от быстрого смешивания, они разделены пористой перегородкой 3 из необожженной глины. Такое устройство, обеспечивает длительное равномерное действие элемента Даниеля в отличие от элемента 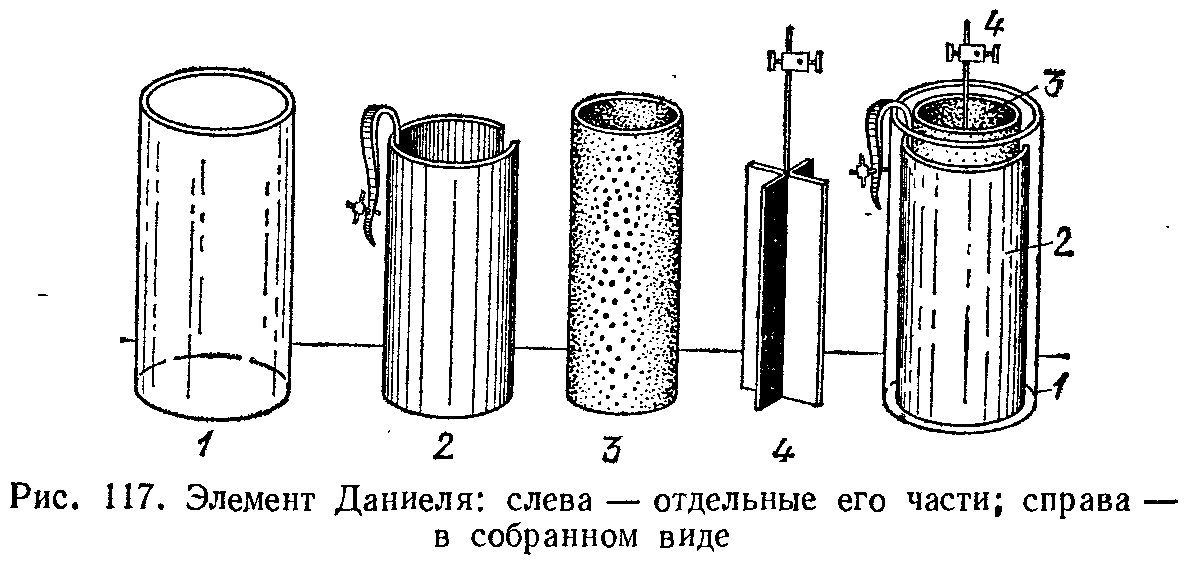 Вольты; э. д. с. элемента Даниеля равна 1,09 В. В большинстве гальванических элементов при длительном их использовании возникают вторичные процессы, изменяющие даваемое этими элементами напряжение. Однако некоторые гальванические элементы отличаются исключительным постоянством напряжения и поэтому находят широкое применение при электрических измерениях в качестве эталона напряжения. Служащие для этого элементы изготовляются по точно установленным международными соглашениями рецептам, определяющим химический состав и концентрацию их электролитов. Они называются нормальными элементами. В настоящее время чаще всего употребляется нормальный элемент Вестона, дающий при 18°С напряжение 1,0187 В.
Вольты; э. д. с. элемента Даниеля равна 1,09 В. В большинстве гальванических элементов при длительном их использовании возникают вторичные процессы, изменяющие даваемое этими элементами напряжение. Однако некоторые гальванические элементы отличаются исключительным постоянством напряжения и поэтому находят широкое применение при электрических измерениях в качестве эталона напряжения. Служащие для этого элементы изготовляются по точно установленным международными соглашениями рецептам, определяющим химический состав и концентрацию их электролитов. Они называются нормальными элементами. В настоящее время чаще всего употребляется нормальный элемент Вестона, дающий при 18°С напряжение 1,0187 В.
Заметим, что э. д. с. того или иного гальванического элемента определяется только подбором металлов и электролитов и совершенно не зависит от площади электродов, соприкасающихся с электролитом. Причины этого станут вполне ясны, когда мы разберем процесс возникновения э. д. с. в элементе.
Дата добавления: 2017-05-02; просмотров: 1989;











