Изопараметрические процессы
Большое значение для теоретических исследований и решения практических задач имеют так называемые изопараметрические процессы, протекающие при постоянном (фиксированном) значении одного из параметров состояния и адиабатный процесс, который протекает без теплообмена с окружающей средой.
Термодинамические процессы удобно иллюстрировать в виде соответствующих линий (кривых) процесса на двумерных фазовых диаграммах. Широкое распространение имеют pv-, Ts-, hs-диаграммы, которые условно показаны на рис. 1.2.
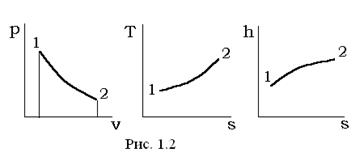
В общем случае расчет любого термодинамического процесса 1-2 при заданных начальных параметрах (p1, v1, T1) должен сводиться к определению конечных параметров (p2, v2, T2) состояний газа (рабочего тела) и вычислению участвующей в процессе теплоты q1-2, изменению внутренней энергии Δu=u2-u1, энтальпие Δh=h2-h1, энтропие Δs=s2-s1 и работе деформации объема рабочего тела l1-2. Таким образом, рассматриваемый процесс однозначно характеризуется значениями следующих функций процесса, параметров состояния и функций состояния:
(p1, v1, T1, p2, v2, T2, Δu, Δh, Δs, q1-2, l1-2). (1.37)
Очевидно, что перечисленный спектр величин должен быть дополнен сведениями о физической природе рабочего тела (cp, cv, μг и т.д.).
Следует отметить, что на pv-диаграмме линии процесса описываются уравнением p·vn=const. (Каждому термодинамическому процессу соответствует свое значение показателя политропы n).
Определим уравнение, описывающее линии процесса на Ts-диаграмме.
 Для этого рассмотрим совместно следующие выражения (1.9) и (1.2):
Для этого рассмотрим совместно следующие выражения (1.9) и (1.2):
δq=сdT,
δq=Tds.
Учитывая равенство левых частей этих выражений, приравниваем их правые части:
сdT= Tds.
В полученном дифференциальном уравнении производим разделение переменных и осуществляем интегрирование
dT/T=ds/c 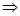
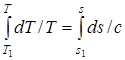
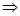
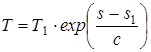 , (1.38)
, (1.38)
где T1, s1 – соответствуют началу процесса; с – теплоемкость рассматриваемого процесса.
Ниже приведены математические зависимости и фазовые диаграммы, необходимые для анализа и осуществления соответствующих расчетов при исследовании конкретных изопараметрических процессов.
При анализе каждого из изопараметрических процессов необходимо определить значения показателя политропы, теплоемкости процесса и изменения функций состояния, а также величину теплоты, принимающей участие в данном процессе и работу расширения, совершаемый ТДС при протекании рассматриваемого процесса.
I. Изохорный процесс v=const, dv=0.
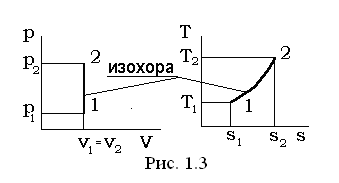
В уравнении линии процесса p×vn=const, (p1/n v=const) условие v=const удовлетворяется при n=¥, а теплоемкость изохорного процесса в соответствии с выражением равна 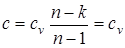 .
.
Из уравнения состояния идеального газа p×v=Rг×T (при условии v=const) следует
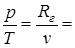 const
const 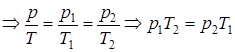 .
.
Перечень величин, представленных в выражении (1.37) в изохорном процессе, взаимосвязан следующими соотношениями:
p1×T2 = p2 ×T1; (1.39)
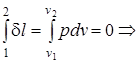 l1-2= 0, v1= v2; (1.40)
l1-2= 0, v1= v2; (1.40)
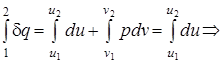 q1-2= u2 - u1; (1.41)
q1-2= u2 - u1; (1.41)
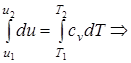 Δu=u2 - u1= cv× (T2 -T1); (1.42)
Δu=u2 - u1= cv× (T2 -T1); (1.42)
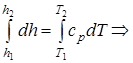 Δh=h2 - h1=cp× (T2 -T1); (1.43)
Δh=h2 - h1=cp× (T2 -T1); (1.43)
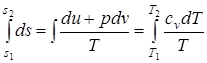
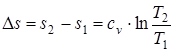 ; (1.44)
; (1.44)
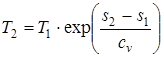 .(1.45)
.(1.45)
II. Изобарный процесс p=const, dp=0
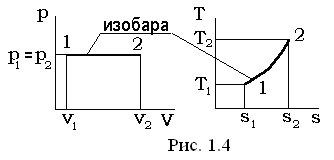
В уравнении политропного процесса p×vn=const, условие р = const удовлетворяется при n = 0; теплоемкость равна 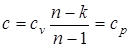 .
.
Из уравнения состояния p×v=Rг×T (при условии p=const) следует 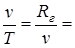 const,
const, 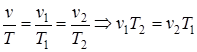 .
.
Соотношения между величинами, представленными в перечне (1.37), определяются путем интегрирования соответствующих выражений, как это производилось при рассмотрении изохорного процесса и имеют окончательный вид:
v1×T2= v2× T1; (1.46)
q1-2= h2 - h1; (1.47)
l1-2= p1× (v2 - v1) = p2× (v2 - v1); (1.48)
Δu=u2 - u1= cv× (T2 -T1); (1.49)
Δh=h2 - h1=cp× (T2 -T1); (1.50)
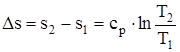 . (1.51)
. (1.51)
III. Изотермический процесс Т=const, dТ=0.
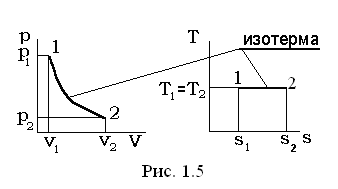
В уравнении политропного процесса T×vn-1=const, условие Т=const удовлетворяется при n = 1, а теплоемкость для этого случая определяется из выражения 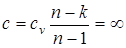 .
.
Из уравнения состояния p×v=Rг×T (при условии T=const) следует p×v=Rг×T = const, pv = p1 v1 = p2 v2Þ p1 v1= p2 v2.
Перечень величин (1.37) в изотермическом процессе взаимосвязан следующими соотношениями:
p1× v1 = p2×v2; (1.52)
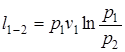 ;
; 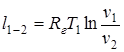 (1.53)
(1.53)
q1-2= l1-2; (1.54)
Δu=u2 - u1= 0; (1.55)
Δh=h2 - h1=0; (1.56)
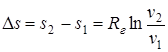 ; (1.57)
; (1.57)
T2=T1. (1.58)
Дата добавления: 2021-07-22; просмотров: 719;











