Химические свойства
Химические свойства пиридина определяются наличием ароматической системы и основного атома азота. Основные и нуклеофильные свойства. Пиридин проявляет слабые основные свойства ( 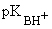 =5,23) за счет неподеленной пары электронов азота и с кислотами образует соли пиридиния.
=5,23) за счет неподеленной пары электронов азота и с кислотами образует соли пиридиния.
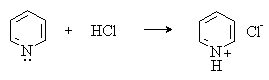
Атом азота пиридина проявляет также нуклеофильные свойства и алкилируется алкилгалогенидами с образованием солей алкилпиридиния.
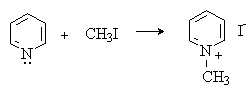
Соли алкилпиридиния легко взаимодействуют с нуклеофильными реагентами, в том числе с комплексными гидридами металлов (NaBH4), с образованием продуктов присоединения. Подобные процессы лежат в основе механизма действия кофермента НАД+(см. лек. № 19).
Реакции электрофильного замещения
Реакции электрофильного замещения для пиридина идут с большим трудом, что обусловлено p -дефицитностью ядра и способностью атома азота образовывать соли с протонными кислотами и комплексы с кислотами Льюиса, что еще больше уменьшает нуклеофильность ядра. По способности к электрофильному замещению пиридин напоминает нитробензол. Атака электрофилами идет по положению 3.
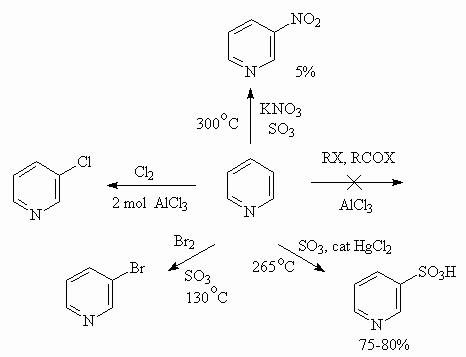
Реакции нуклеофильного замещения
Наиболее характерными для пиридина являются реакции нуклеофильного замещения, которые идут по положениям 2 и 4. Примерами таких реакций является взаимодействие пиридина с амидом натрия (реакция Чичибабина) и со щелочами.
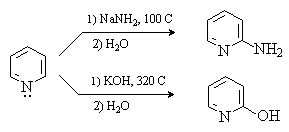
Окисление и восстановление
Цикл пиридина устойчив к действию окислителей. Алкилпиридины окисляются с образованием пиридинкарбоновых кислот.
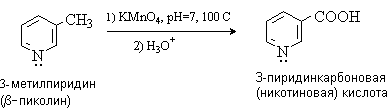
Пиридин гидрируется в жестких условиях с образованием насыщенного гетероцикла – пиперидина.
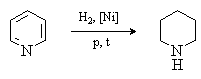
Соли алкилпиридиния легко восстанавливаются комплесными гидридами металлов (см. выше).
Дата добавления: 2017-04-05; просмотров: 2042;











