Влияние магнитного поля на свойства воды и ее примесей
Магнитная обработка воды производится в аппаратах, в которых поток охлаждающей жидкости пересекает силовые линии магнитного поля, напряженностью 10 А/м, создаваемого электромагнитной катушкой или постоянными магнитами.
Экспериментально установлено, что при наложении магнитного поля на нестабильную по карбонату кальция воду, содержащую ферромагнитные примеси (Fe3O4, Fe2O3), происходит снижения интенсивности образования отложений на теплопередающих поверхностях и повышается количество выпадающего шлама. Это явления объясняется накоплением ферромагнитных оксидов железа в зазоре магнитного аппарата (магнитное фильтрование) и ведет к образованию кристаллов, снижающих накипеобразование за счет реакций выпадения шлама в толще воды. Применять эту технологию для широкого использования без предварительного получения результатов на экспериментальных установках не рекомендуется.
Электродиализ — процесс удаления из растворов ионов растворенных веществ путем переноса их через мембраны в поле постоянного электрического тока. При наложении постоянного электрического поля на раствор в последнем возникает движение катионов (включая ион водорода) к отрицательно заряженному катоду, а анионов — к аноду. При контакте ионов с соответствующими электродами протекают катодные реакции восстановления:
2Н+ + 2е ® 2Н; 2Н ® Н2;
Na+ + e ® Na; 2Na + 2H2O ® 2Na+ + 2OH- + H2
и анодные реакции окисления:
4ОН- - 4е ® 2Н2О + 2О; 2О ® О2;
2Cl- - 2e ® 2Cl; 2Cl ® Cl2;
2Cl + Н2О ® 2Н+ + 2Cl- +О.
Если в электродную ячейку поместить около катода мембрану, выполненную из катионита и пропускающую только катионы, а около анода мембрану из анионита, пропускающую только анионы, что исключит перенос ионов Н+ и ОН-, образующихся у электродов, то объем ячейки будет разделен на три камеры. В этом случае в катодную камеру из средней, могут проходить только катионы, движущиеся к катоду, а в анодную — только анионы, движущиеся к аноду. Концентрация ионов в средней камере будет уменьшаться, т.е. вода станет менее минерализованной, а в приэлектродных камерах она будет увеличиваться.
Теоретическое количество электричества Qтеор, расходуемого на перенос 1 г-экв вещества, по закону Фарадея равно 26,8 А . ч, или 96 491 Кл, а количество электричества, А .ч, необходимого для деминерализации 1 м воды от концентрации C1 до концентрации С2 (г-экв/м3), определяется по формуле:
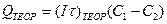 ,
,
где I — сила тока, пропускаемого через раствор, А; τ — время, ч.
На практике при реализации электродиализа наблюдаются потери напряжения на преодоление электрических сопротивлений в ячейках и на электродах, поэтому потребляемое фактическое количество электричества превышает теоретическое. Степень совершенства электродиализа характеризуется коэффициентом выхода по току ηэ, выражаемого как
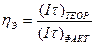
Значение ηэ теоретически изменяется в пределах от 0,3 (для неактивных мембран) до 1,0 (в идеальном процессе). Потери напряжения на электродах (3—4 В) существенно превышают потери на электрическое сопротивление в мембранах и растворе (1—2 В), поэтому в трехкамерном электродиализаторе свыше 2/3 энергии расходуется бесполезно.
Для снижения перечисленных потерь до 3—5 % применяются многокамерные электродиализаторы (рис. 6.1), состоящие из большого числа узких камер (до 300 шт). В крайних камерах аппарата помещают катод и анод, изготовленные для предотвращения их растворения из электрохимически инертного материала (платинированного титана). Исходная вода, поступающая в четные камеры (рис. 6.1), теряет ионы примесей, т.е. обессоливается. В нечетных камерах вода обогащается солями. Обессоленная вода и концентрат (рассол) собираются и раздельно выводятся из аппарата.

Рисунок 6.1 - Схема многокамерного электродиализатора: К – катионитная мембрана, пропускающая только катионы; А – анионитная мембрана, пропускающая только анионы.
Ионитные мембраны, используемые в процессе электродиализа, должны обладать высокой селективностью, малой проницаемостью для молекул воды, хорошей электрической проводимостью, высокой механической прочностью, химической стойкостью, иметь длительный срок службы в промышленных условиях.
Препятствиями для глубокого обессоливания воды в процессе электродиализа являются:
1) повышение электрического сопротивления в камерах с ростом степени обессоливания;
2) перенос воды через мембраны в процессе осмоса;
3) разложение воды при высоких плотностях тока;
 4) возможность образования осадков на мембранах в камерах концентрирования. Экспериментально показано, что при концентрации солей в камерах обессоливания ниже 200—300 мг/дм3 резко возрастает расход энергии, что ограничивает глубину обессоливания воды указанными пределами.
4) возможность образования осадков на мембранах в камерах концентрирования. Экспериментально показано, что при концентрации солей в камерах обессоливания ниже 200—300 мг/дм3 резко возрастает расход энергии, что ограничивает глубину обессоливания воды указанными пределами.
Рисунок 6.2 - Схема возникновения концентрационной поляризации на анионитной мембране: А — анионитная мембрана; δ — толщина граничного слоя воды; I — концентрация анионов.
Ограничение плотности тока при электродиализе связано с явлением концентрационной поляризации, возникающим на ионитных мембранах. Суть этого явления заключается в том, что движение ионов через мембрану под действием электрического тока идет быстрее, чем в растворе, что приводит к падению концентрации около принимающей стороны мембраны и к повышению ее около отдающей стороны (рис. 6.2). Существует такая плотность тока, называемая предельной, при которой концентрация переносимого иона около принимающей стороны мембраны снижается до 0 и начинается перенос ионов Н+ и ОН-, образовавшихся при электролизе воды. Этот процесс вызывает перерасход электроэнергии, не снижая солесодержания воды, и приводит к изменению рН среды, что может вызвать образование осадков на мембранах.
С учетом отмеченных ограничений оптимальный уровень снижения солесодержания обрабатываемой воды в одноступенчатых электродиализных аппаратах не превышает 40—50 %.
Для предотвращения образования осадков кроме ограничения рабочей плотности тока производят подкисление воды, переполюсовку напряжения, попеременный пропуск воды через обессоливающие и рассольные камеры.
Дата добавления: 2017-03-12; просмотров: 2255;











