Основные характеристики природной воды
1.1. Поступление примесей в воду
Природная вода, разделяемая условно на атмосферную (дождь, туман, снег), поверхностную (реки, озера, пруды, болота), подземную (артезианские скважины, шахтные колодцы) и морскую (моря, океаны), всегда содержит различные примеси. Характер и количество имеющихся в воде примесей определяет качество воды т.е. характеризует возможность использования ее для различных целей в промышленности и в быту.
Примеси поступают в воду, находящуюся в природном круговороте, из окружающей ее среды. Вода, занимающая около 70 % поверхности Земли, испаряясь, поступает в атмосферу, а после конденсации водяных паров в верхних слоях атмосферы возвращается на поверхность Земли в виде осадков, образуя поверхностные и подземные стоки и водоемы. Подземные стоки создаются при просачивании атмосферной воды в более или менее глубокие слои почвы, где вода собирается над водонепроницаемыми пластами, стекает по ним и выходит вновь на поверхность земли в местах выхода этих пластов, сливаясь с поверхностными стоками. Далее вода в руслах рек и ручьев перемещается к озерам, морям, водохранилищам, завершая этим свой природный круговорот.
Наряду с природным существует производственно-бытовой круговорот воды, создаваемый в результате потребления ее для различных целей (охлаждение, коммунальное водоснабжение и т.п.).
Примеси поступают в воду на всех этапах отмеченных круговоротов. При конденсации влаги в атмосфере в конденсате растворяется кислород, азот, углекислый газ в соответствии с их парциальными давлениями, а в промышленных районах – также значительное число оксидов серы и других продуктов, содержащихся в дымовых газах. Суммарное солесодержание атмосферных осадков составляет в среднем 10 мг/дм3. Просачиваясь через грунт, вода встречается с различными минеральными солями (NaCl, Na2SO4, MgSO4, CaCO3, силикатами и др.) и органическими веществами, растворяет или механически захватывает их. При одновременном присутствии в воде кислорода, органических веществ и микроорганизмов (бактерий), постоянно находящихся в поверхностных слоях почвы, создаются условия для перевода основных составляющих ряда органических веществ в минеральные кислоты (углерода в угольную, азота в азотную, серы в серную, фосфора в фосфорную и т.п.). Образующиеся в подпочвенных водах кислоты взаимодействуют с широко распространенными в природе известняками – карбонатами кальция, железа, доломитами CaMg(CO3)2 и другими породами, что приводит к поступлению в воду хорошо растворимых бикарбонатов Ca, Mg, Fe, например:
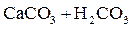 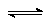 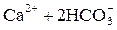 ; ;
| (1.1) |
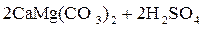  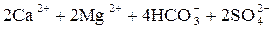 ; ;
| (1.2) |
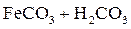 → → 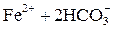 . .
| (1.3) |
Коренные горные породы – сложные силикаты (граниты, кварцевые породы), они весьма слабо растворимы в воде и лишь при длительном контакте обогащают воду растворимыми силикатами в небольшой концентрации (5–15 мг/дм3).
При прохождении воды через толщу почвы, захваченные ею механические грубодисперсные примеси отфильтровываются, в связи с чем грунтовые (лежащие вблизи поверхности земли) и артезианские (лежащие более глубоко между двумя водонепроницаемыми пластами) воды характеризуются невысокой концентрацией взвешенных и органических примесей. В то же время десорбция углекислоты из таких вод затруднена в связи со слабым газообменом их с атмосферой, что приводит к интенсивному растворению карбонатных пород (см. уравнения реакций (1.1) – (1.3)) и большому насыщению подземных вод бикарбонатами.
Фильтрация воды через почву частично сопровождается ионообменной адсорбцией ионогенных примесей; так, почвенные комплексы хорошо задерживают фосфаты, происходит обмен адсорбированного почвой Na+на К+ и т.п. Поэтому, несмотря на примерно одинаковую распространенность натрия и калия в природе, в поверхностной воде среднее соотношение концентраций [Na+]:[К+] составляет большей частью 10:1.
Существенно большим разнообразием примесей по сравнению с природными водами характеризуются производственно-бытовые стоки. По характеру загрязнений эти стоки подразделяют на три группы: бытовые сточные воды; производственные сточные воды; стоки, образующиеся при лесозащитных и растениеводческих работах.
Бытовые сточные воды и стоки лесозащитных и растениеводческих работ с применением реагентов имеют более или менее однообразный состав: белковые вещества и продукты их распада, жиры, мочевину, мыло, синтетические моющие средства, удобрения и т.п.
Эти примеси в основном относятся к классу органических веществ и в водной среде окисляются под действием кислорода и микроорганизмов.
Загрязнения производственных стоков определяются главным образом типом предприятия, на котором они образуются. Концентрация примесей (кислот, щелочей, нейтральных солей, нефтепродуктов, органических соединений) в сточных водах, подлежащих переработке и повторному использованию, может достигать несколько граммов на один кубичесий дециметр воды и оказывать резко отрицательное влияние на водно-химический и биохимический режимы водостока при аварийных сбросах: снижение концентрации кислорода, изменения рН, отравляющее действие, заиливание и т.п., поэтому бесконтрольный сброс сточных вод в природные водотоки запрещен в законодательном порядке.
1.2. Классификация, характеристика вод и их примесей
Природные воды классифицируют по ряду признаков, простейшим из них является солесодержание воды. В соответствии с солесодержанием различают
· пресную воду – солесодержание 1 г/дм3;
· солоноватую – солесодержание 1–10 г/дм3;
· соленую – солесодержание более 10 г/дм3;
Большое распространение получила предложенная О.А. Алехиным система, по которой воды различаются по преобладающему в них аниону: гидрокарбонатный класс вод с преобладающим анионом 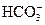 или суммой анионов
или суммой анионов 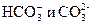 (С), сульфатные воды (S), хлоридные воды (Cl). По преобладающему катиону классы вод делятся на три группы: кальциевую (Са), магниевую (Mg) и натриевую (Na). Реки средней полосы европейской части России в основном относятся к гидрокарбонатному классу кальциевой группы (ССа).
(С), сульфатные воды (S), хлоридные воды (Cl). По преобладающему катиону классы вод делятся на три группы: кальциевую (Са), магниевую (Mg) и натриевую (Na). Реки средней полосы европейской части России в основном относятся к гидрокарбонатному классу кальциевой группы (ССа).
Примеси природных вод по степени дисперсности (крупности) подразделяют: на истинно-растворимые (ионно- или молекулярно-дисперсные), распространенные в воде в виде отдельных ионов, молекул; коллоидно-дисперсные с размером частиц от 1 до 100 нм; грубодисперсные с размером частиц более 100 нм (0,1 мкм).
Коллоидные примеси представляют собой агломераты из большого числа молекул с наличием поверхности раздела между твердой фазой и водой. Из-за малых размеров коллоидные частицы не теряют способности к диффузии и имеют значительную удельную поверхность.
Например, если кубик вещества объемом 1 см3 раздробить на более мелкие кубики с длиной ребра 10 нм, то количество таких кубиков составит 1018единиц с общей площадью поверхности 600 м2.
Коллоидные частицы не выделяются из воды под действием силы тяжести, не задерживаются обычными фильтрующими материалами (песком, фильтрующей бумагой) и различимы в рассеянном свете (конус Тиндаля). В природных водах в коллоидно-дисперсном состоянии находятся различные производные кремниевой кислоты и железа, органические вещества – продукты распада растительных и животных организмов.
Грубодисперсные примеси (так называемые взвешенные вещества) имеют столь большую массу, что практически не способны к диффузии. С течением времени устанавливается определенное седиментационное равновесие, примеси либо выпадают в осадок, либо всплывают на поверхность (при плотности частиц меньше плотности воды).
Длительно оставаясь во взвешенном состоянии, грубодисперсные примеси обусловливают мутность воды. Чем больше размер частиц грубодисперсных примесей, тем быстрее устанавливается седиментационное равновесие, и тем легче выделяются они из воды при отстаивании или фильтрации. Так, скорость отстаивания частиц песка и ила размером 100 и 20 мкм составляет в неподвижной воде при 10 °С соответственно около 7 и 0,4 мм/с.
По химическому составу примеси природных вод можно разделить на два типа: минеральные и органические.
К минеральным примесям воды относятся растворенные в ней содержащиеся в атмосфере газы N2, O2, СО2, а также газы, вносимые сточными водами, различные соли, кислоты, основания, в значительной степени находящиеся в диссоцинированной форме, т.е. в виде образующих их катионов и анионов.
К органическим примесям природных вод относят гумусовые вещества, вымываемые из почв и торфяников, а также органические вещества различных типов, поступающие в воду совместно с сельскохозяйственными стоками и другими типами недостаточно очищаемых стоков.
1.3. Характеристика ионизированных примесей
Механизм поступления примесей в природную воду формирует определенное постоянство типа важнейших ионов, содержащихся в различных водотоках и водоемах. Сведения о наиболее распространенных в природных водах ионах и их концентрациях приведены в табл. 1.1.
Таблица 1.1
Важнейшие ионы природных вод
| Группа | Катион | Анион | Концентрация, мг/дм3 |
| I | 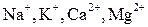
| 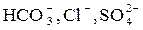
| От нескольких единиц до десятков тысяч |
| II | 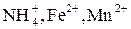
| 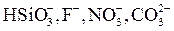
| От десятых долей до единицы |
| III | 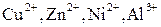
| 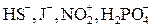
| Менее десятых долей |
Характеризуя ионированные примеси, можно отметить следующее.
Ионы натрия и калия с анионами природных вод не образуют труднорастворимых простых солей, поэтому их относят к группе устойчивых примесей. Концентрация Na+, K+ изменяется только в результате испарения или разбавления природной воды, при анализе воды ее часто выражают суммарно.
Ионы кальция и магния относят к числу важнейших примесей воды, они во многом определяют возможность ее использования для различных народнохозяйственных целей, так как образуют труднорастворимые соединения с некоторыми находящимися в воде анионами. При использовании природной воды и связанным с ним изменением исходных концентраций катионов и анионов, например при упаривании или снижении растворимости с ростом температуры, происходит выделение труднорастворимых солей кальция и магния на теплопередающих поверхностях в виде твердой фазы.
В технологических процессах подготовки воды для снижения концентрации кальция и магния часто используется образование их труднорастворимых соединений, выводимых из воды до поступления ее в водопаровой тракт.
Ионы железа характеризуются поливалентностью и могут находиться в различных формах: Fe2+ и Fe3+. Необходимо отметить, что обратный логарифм произведения растворимости 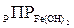 при 25 °С равен 14,75, а
при 25 °С равен 14,75, а 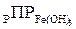 составляет 37,2 единицы. Исходя из этих значений и ионного произведения воды, можно вычислить, что для поддержания равновесного насыщения воды ионами железа на уровне 0,1 мг/дм3 для закисного железа рН воды следует довести до 9,2, а для оксидного – до 3,5; при увеличении концентрации Fe3+в ионной форме рН раствора будет понижаться. Во всех природных водах с высоким рН ионы Fe3+ практически не могут содержаться и все соединения Fe3+ находятся в коллоидной или грубодисперсной форме.
составляет 37,2 единицы. Исходя из этих значений и ионного произведения воды, можно вычислить, что для поддержания равновесного насыщения воды ионами железа на уровне 0,1 мг/дм3 для закисного железа рН воды следует довести до 9,2, а для оксидного – до 3,5; при увеличении концентрации Fe3+в ионной форме рН раствора будет понижаться. Во всех природных водах с высоким рН ионы Fe3+ практически не могут содержаться и все соединения Fe3+ находятся в коллоидной или грубодисперсной форме.
В подземных водах железо обычно находится в ионной форме в виде двухвалентного железа, стехиометрически отвечающего формуле соединения Fe(HCO3)2, которое при условиях удаления растворенной углекислоты (выдерживание в открытых сосуде) легко гидролизуется, а при наличии в воде растворенного кислорода окисляется с образованием красно-коричневой твердой фазы гидроксида железа Fe(OН)3:
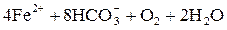 →4Fe(OH)3(T) + 8CO2. →4Fe(OH)3(T) + 8CO2.
| (1.4) |
В водах поверхностных источников железо может входить также в состав органических соединений, присутствие в воде соединений железа в повышенных концентрациях создает условия для развития железобактерий, образующих бугристые колонии на стенках трубопроводов.
Концентрация железа в исходной воде может увеличиваться в процессе транспортирования ее по стальным и чугунным трубам вследствие загрязнения продуктами коррозии.
Гидрокарбонат-ионы 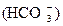 – важнейшая составная часть солевых компонентов воды. В природных водах кроме “полусвязанной” углекислоты (ионы
– важнейшая составная часть солевых компонентов воды. В природных водах кроме “полусвязанной” углекислоты (ионы 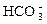 – называемые также бикарбонатами), а в некоторых случаях и “связанной” углекислоты (ионы
– называемые также бикарбонатами), а в некоторых случаях и “связанной” углекислоты (ионы 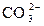 ) содержится также так называемая “свободная” углекислота, находящаяся в виде растворенного газа СО2 и его гидрата – молекул Н2СО3. Между различными формами угольной кислоты существует кинетическое равновесие, связанное с величиной рН и содержанием ионов кальция в растворе.
) содержится также так называемая “свободная” углекислота, находящаяся в виде растворенного газа СО2 и его гидрата – молекул Н2СО3. Между различными формами угольной кислоты существует кинетическое равновесие, связанное с величиной рН и содержанием ионов кальция в растворе.
Хлорид-ионы (Cl-) с катионами не образуют труднорастворимых солей и при температуре около 25 °С не подвергаются гидролизу или окислению.
Сульфат-ионы 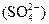 в поверхностных водах, не загрязненных органическими веществами, достаточно устойчивы; как ионы сильной кислоты, они не подвергаются гидролизу и образуют относительно труднорастворимую соль только с одним из катионов природных вод – Са2+. Однако растворимость сульфата кальция при обычной температуре достаточно высока (около 1 г/дм3), и в природных водах, как правило, не происходит выделения твердой фазы СаSO4.
в поверхностных водах, не загрязненных органическими веществами, достаточно устойчивы; как ионы сильной кислоты, они не подвергаются гидролизу и образуют относительно труднорастворимую соль только с одним из катионов природных вод – Са2+. Однако растворимость сульфата кальция при обычной температуре достаточно высока (около 1 г/дм3), и в природных водах, как правило, не происходит выделения твердой фазы СаSO4.
1.4. Кремнесодержащие соединения и органические примеси
Кремниевая кислота.Различные соединения кремниевой кислоты весьма распространены в природных водах; в подземных водах силикатов содержится больше, чем в поверхностных. Ангидрид кремниевой кислоты (SiO2) c водой может образовывать кислоты типа метакремниевой H2SiO3 (SiO2·H2O), ортокремниевой H4SiO4 (SiO2·2H2O) и различных поликремниевых, например двуметакремниевой H2SiO5 (2SiO2·H2O) и т.д. Все эти кислоты при обычных для природных вод значениях рН малорастворимы и способны образовать в воде коллоидные растворы.
Многообразие форм кремниевых кислот и сравнительно малая их растворимость в воде (например, кремнесодержание в воде при t = 20 °С достигает 150 мг/дм3, t = 100 °С достигает 500 мг/дм3) сильно затрудняют их дифференциацию при анализе воды, поэтому в результате анализа обычно получают только суммарную концентрацию кремнесодержащих соединений, условно выраженную в виде 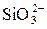 , так называемое кремнесодержание воды.
, так называемое кремнесодержание воды.
Кальциевые и магниевые соли кремниевых кислот различных типов, а также ферро- и алюмосиликаты значительно труднее растворяются в воде.
В поверхностных и артезианских водах общее кремнесодержание в пересчете на 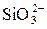 обычно составляет от 1 до 30 мг/дм3, при этом от 5 до 20 %
обычно составляет от 1 до 30 мг/дм3, при этом от 5 до 20 % 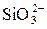 представлено коллоидной формой. При значениях рН > 8 кремниевая кислота может находиться в воде в виде
представлено коллоидной формой. При значениях рН > 8 кремниевая кислота может находиться в воде в виде 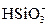 лишь в отсутствие ионов Са2+ и Mg2+.
лишь в отсутствие ионов Са2+ и Mg2+.
Органические примеси. Органические вещества, попадающие в открытые водоемы в результате вымывания их из почв и торфяников, объединяют обычно под общим названием гумусовых. Особенно загрязнены гумусовыми веществами, имеющими характерную желтую или коричневую окраску, водотоки болотного происхождения. Кроме того, поверхностные воды обогащаются органическими веществами в результате отмирания водной флоры и фауны с последующими процессами их химического и биохимического распада.
Гумусовые вещества природных вод разделяют условно на три группы, объединяющие органические примеси по более или менее близким физическим и химическим свойствам: 1) гуминовые кислоты (формула С60Н52О24 (СООН)4) обычно находятся в водоемах в виде коллоидов, переходя в истинно растворенное состояние лишь при высоких значениях рН; 2) коллоидные соединения фульвокислот; 3) истинно растворенные соединения фульвокислот.
Водород карбоксильных групп СООН гуминовых кислот может замещаться катионами с образованием солей, называемых гуматами. Гуматы щелочных металлов и аммония хорошо растворимы в воде, в то время как гуматы кальция, магния и железа труднорастворимы. Гуминовые кислоты могут также образовывать с гидроксидами железа и алюминия комплексные соединения, частично представленные и коллоидной формой.
Большое значение в увеличении количественного и качественного содержания органических веществ в поверхностных водоемах и водотоках играют недостаточно очищенные бытовые, производственные, а также сельскохозяйственные стоки. Известно, что органические вещества являются главной причиной ухудшения органолептических свойств воды, т. е. появления запахов и привкусов.
Из-за сложности индивидуальной классификации органических примесей каждого типа в практике анализа используют общую способность органических примесей окисляться под действием специфических окислителей. Этот критерий не дает точного представления о реальной концентрации органических веществ в воде, однако позволяет приближенно характеризовать и сравнивать воды различного типа.
1.5. Закономерности изменения количественного состава примесей по районам и сезонам для поверхностных и подземных вод
Подземные водотоки, выходя на поверхность земли, играют значительную роль в питании рек, поэтому солевой состав рек зависит от характера почв и грунтов, с которых они собираются. Вследствие этого воды некоторых северных рек (Печора, Вятка, Нева), стекающих в районах сильновымытых или скальных грунтов, характеризуются малой минерализованностью (около 150 мг/дм3). Воды рек южных районов (Эмба, Миус, Амударья), протекающих по сильно засоленным почвам, содержат до 1000 мг/дм3 растворенных примесей. Если река протекает через районы с различными географическими условиями и геологическим строением (например, Волга), минерализованность ее воды может меняться на протяжении от истока до устья в 2–3 раза. Изменением характеристик грунтов и почв в направлении с севера на юг европейской части определяется эмпирическое правило повышения солесодержания рек в указанном направлении.
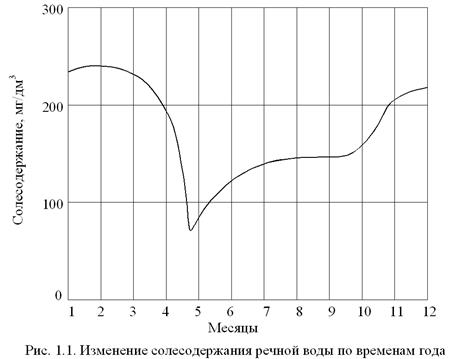
Количественный и качественный состав примесей рек и водоемов зависит от метеорологических условий и подвержен сезонным колебаниям. Так, в весенний паводковый период, после вскрытия льда, воды содержат минимальное количество растворенных солей, однако характеризуются максимальным количеством взвешенных веществ, увлекаемых с поверхности почвы быстрыми потоками талых вод. В зимний период в результате питания поверхностного водотока подземными водами его солесодержание достигает максимума (рис. 1.1). В летнее время состав речной воды определяется соотношением в питании долей поверхностного и подземного стоков.
Отмеченные географические и сезонные изменения состава природных вод необходимо учитывать при использовании показателей качества природной воды, с тем чтобы не определять пригодность водотока по результатам единичного наблюдения, выполненного на значительном расстоянии от планируемого места водозабора.

|
1.6. Технологические, качественные показатели воды
В зависимости от характера использования воды различными потребителями определяются и показатели, необходимые для качественной и количественной характеристики воды.
Важнейшими показателями качества воды для использования ее в теплоэнергетике являются
– концентрация грубодисперсных веществ (ГДП);
– концентрация истинно-растворимых примесей (ионный состав);
– концентрация коррозионно-активных газов;
– концентрация ионов водорода;
– технологические показатели, в которые входят сухой и прокаленный остаток, окисляемость, жесткость, щелочность, кремнесодержание, удельная электропроводность и т.д.
Концентрация грубодисперсных веществ в воде может быть достаточно точно определена фильтрованием воды через бумажный фильтр с последующим его высушиванием при температуре 378–383 К до постоянной массы. Однако на практике предпочитают использовать методы определения грубодисперсных веществ по прозрачности и мутности воды.
Прозрачность воды определяют при повышенных концентрациях ГДП в воде при помощи стеклянной трубки, залитой водой, на дне которой расположен шрифт или крест с шириной линии 1 мм. Высота столба воды, при которой определяется хорошая видимость шрифта или креста, является количественной оценкой прозрачности воды. При малых концентрациях ГДП (< 3мг/дм3) используется нефелометрический метод, основанный на сравнении мутности анализируемой воды с соответствующим эталоном. Концентрация ГДП может быть также определена по разности значений плотного и сухого остатков, полученных при упаривании одного кубического дециметра соответственно нефильтрованной и фильтрованной воды.
Сухой остаток позволяет косвенно судить о солесодержании воды, т.е. о сумме всех анионов и катионов в воде, за исключением ионов Н+ и ОН-. Однако при образовании сухого остатка несколько изменяется ионный состав примесей за счет разложения бикарбонатов. В сухой остаток входит также часть органических и коллоидных примесей. Прокаливание сухого остатка при температуре 1073 К приводит к сгоранию органических примесей и распаду карбонатов. Поэтому разность значений плотного и сухого остатков позволяет лишь ориентировочно оценить концентрацию органических примесей в воде.
Концентрации отдельных ионов в воде, (мг/дм3 или кмоль/дм3), определяемых методами химического анализа. Правильность проведения анализа должна подтверждаться выполнением закона электронейтральности: 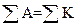 ммоль/дм3. Возможная ошибка при этом не должна превышать 1 %.
ммоль/дм3. Возможная ошибка при этом не должна превышать 1 %.
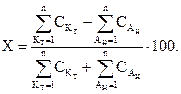
| (1.5) |
Если ошибка превышает 1 %, то следует проверить качество анализа отдельных ионов или повторить весь анализ.
Суммарная концентрация всех катионов и анионов в воде составляет содержание воды, при этом не учитываются анионы кремниевой кислоты из-за неопределенности сведений об их концентрации в ионной форме, полуторные оксиды и ионы Н+ и ОН-. В случае крепких растворов ионы Н+ и ОН- следует учитывать при подсчете солесодержания.
Жесткость воды является одним из важнейших показателей, определяющих пути использования воды в теплоэнергетике. Общей жесткостью воды ЖО называется суммарная концентрация ионов кальция и магния выражаемая в ммоль/дм3, а при малых значениях – в мкмоль/дм3. По определяющему катиону общая жесткость воды подразделяется на кальциевую ЖСа и магниевую ЖMg. Часть общей жесткости, эквивалентная концентрации бикарбонат-ионов и карбонат-ионов в воде, называется карбонатной жесткостью ЖК, а остальная часть, эквивалентная содержащимся в воде другим анионам 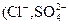 и др), – некарбонатной жесткостью ЖНК.
и др), – некарбонатной жесткостью ЖНК.



 ЖСа ЖО ЖMg.
ЖСа ЖО ЖMg.
ЖК ЖНК
 |  |
Ca(HCO3)2 CaSO4
MgCO3 MgCl2
Общей щелочностью воды ЩО (ммоль/дм3) называется суммарная концентрация всех анионов слабых кислот и ионов гидроксида за вычетом концентрации ионов водорода:
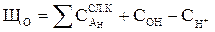 . .
| (1.6) |
Характер анионов слабых кислот, обусловливающих общую щелочность, позволяет подразделять ее на гидратную щелочность (равную концентрации ионов ОН-), силикатную 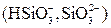 , фосфатную (
, фосфатную ( 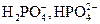 и
и 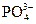 ), бикарбонатную
), бикарбонатную 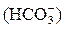 и карбонатную
и карбонатную 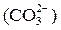 .
.
Обычно в природных водах бикарбонатная щелочь существенно преобладает над другими видами щелочности, поэтому ее значение без большой погрешности выражает общую щелочность воды. Поправка на концентрацию ионов Н+ при определении щелочности вводится при присутствии в воде слабых кислот в свободном состоянии, так как при их диссоциации образуются в эквивалентных количествах анионы слабых кислот и анионы Н+.
Пример 1.1. Вода имеет следующий cостав примесей (ммоль/дм3) 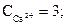
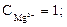
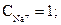
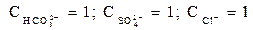 . Определить жесткость и щелочность воды. Проверим правильность представленного анализа:
. Определить жесткость и щелочность воды. Проверим правильность представленного анализа: 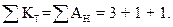
Общая жесткость воды
ЖО = ЖСа + ЖMg = 3 + 1 = 4 ммоль/дм3,
где ЖСа = 3 ммоль/дм3; ЖMg = 1 ммоль/дм3.
Щелочность воды
ЩО = ЩК + ЩНК = 3 + 0 =3 ммоль/дм3;
ЖК = ЩК = 3; ЖНК = ЖО - ЖК = 4 – 3 = 1 ммоль/дм3.
Удельная электропроводностьводы (См/см) характеризуется электрической проводимостью слоя воды, находящегося между двумя противоположными гранями куба с ребром, равным 10-2 м. Она косвенно связана с суммарной концентрацией примеси в истинно-растворенном состоянии (солесодержанием). В чистой воде, не содержащей примесей, перенос зарядов осуществляется лишь ионами Н+ и ОН-. Удельная проводимость такой воды при температуре 293 К составляет 0,04 мкСм/cм. В растворах связь между электропроводимостью и концентрацией ионных примесей зависит от множества факторов, в том числе от температуры, вида ионов, степени диссоциации, что существенно затрудняет измерение. Более определенная связь существует в растворах при постоянных температуре и степени диссоциации.
Концентрация растворенных газов в воде зависит от множества факторов: природы газа, температуры воды, степени минерализации воды, парциального давления газа над водой, рН воды и т.п. Это во многих случаях существенно затрудняет их аналитическое определение в технологических процессах и требует специальных методов анализа. Концентрация СО2 в природной воде существенно зависит от степени углекислотного равновесия и составляет примерно 0,5 мг/дм3 (10-5 моль/дм3) при температуре 293 К.
Концентрация О2 в значительной степени зависит от содержания в воде органических веществ и температуры. При увеличении температуры от 273 до 308 К концентрация кислорода в чистой воде уменьшается от 14,6 до 6,5 мг/дм3.
Показатель концентрации водородных ионов (рН) воды характеризует реакцию воды (кислая, щелочная, нейтральная) и учитывается при всех видах обработки воды.
В соответствии с законом действующих масс вода частично диссоциирует на ионы Н+ и ОН-, согласно уравнению
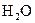  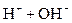 . .
| (1.7) |
Значение рН водных растворов определяет интенсивность диссоциаций содержащихся в них слабых кислот или оснований. С понижением рН, т.е. с повышением активности (или концентрации) ионов Н+, процентное содержание недиссоциированных молекул слабых кислот повышается, а содержание их анионов понижается (табл. 1.2), для катионов слабых оснований наблюдается обратное соотношение, рН природной воды обычно колеблется в пределах 6–8 и зависит в основном от соотношения в воде концентраций 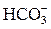 и Н2СО3. Измерение рН основано на определении разности электрических потенциалов (потенциометрический метод) двух помещенных в анализируемый раствор электродов – индикаторного и электрода сравнения.
и Н2СО3. Измерение рН основано на определении разности электрических потенциалов (потенциометрический метод) двух помещенных в анализируемый раствор электродов – индикаторного и электрода сравнения.
Таблица 1.2
Состояние диссоциации слабых оснований и кислот при различных значениях рН и температуре 25 °С, %
| Вещество | рН | |||||||||||||
| 4,5 | 5,5 | 6,5 | 7,5 | 8,5 | 9,5 | 10,5 | ||||||||
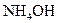
| - | - | - | - | - | - | 0,6 | 1,6 | 5,3 | 15,0 | 35,8 | 63,7 | 84,8 | 94,6 |
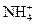
| - | - | - | - | - | - | 99,4 | 98,4 | 94,7 | 85,0 | 64,2 | 36,3 | 15,2 | 5,4 |
 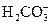
| 99,6 | 98,7 | 95,9 | 88,0 | 69,9 | 42,3 | 18,9 | 6,8 | 2,3 | 0,7 | 0,2 | - | - | - |
 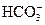
| 0,4 | 1,3 | 4,1 | 12,0 | 30,1 | 57,7 | 81,1 | 93,0 | 97,3 | 97,8 | 95,3 | 87,0 | 68,0 | 40,2 |
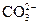
| - | - | - | - | - | - | - | 0,2 | 0,4 | 1,5 | 4,5 | 13,0 | 32,0 | 59,2 |
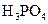
| 1,3 | 0,4 | 0,1 | - | - | - | - | - | - | - | - | - | - | - |
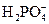
| 98,6 | 99,4 | 99,3 | 98,0 | 94,2 | 83,6 | 61,7 | 33,8 | 13,9 | 4,9 | 1,6 | 0,5 | 0,1 | - |
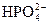
| 0,1 | 0,2 | 0,6 | 2,0 | 5,8 | 16,4 | 38,3 | 66,2 | 86,1 | 95,1 | 98,3 | 99,2 | 98,9 | 96,9 |
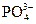
| - | - | - | - | - | - | - | - | - | - | 0,1 | 0,3 | 1,0 | 3,1 |
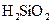
| - | - | 100,0 | - | 99,9 | - | 99,6 | - | 96,1 | - | 71,5 | - | 20,0 | 4,0 |
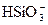
| - | - | - | - | 0,1 | - | 0,4 | - | 3,9 | - | 28,5 | - | 79,9 | 95,4 |
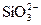
| - | - | - | - | - | - | - | - | - | - | - | - | 0,1 | 0,6 |
Окисляемость воды – это показатель, имеющий условное значение и представляющий собой расход какого-либо сильного окислителя, необходимого для окисления в определенных условиях органических примесей, которые содержатся в 1 л воды. Обычно для этих целей применяется перманганат калия (КMnO4) или бихромат калия (K2Cr2O7), различая соответственно перманганатную и бихроматную окисляемость. Результаты определения перманганатной окисляемости воды выражаются в кислородных или перманганатных единицах (О2, КMnO4), т.е миллиграмм на кубический дециметр (мг/дм3), различающихся в 3,95 раза. Бихроматная окисляемость обычно превышает перманганатную в 2–2,5 раза, а разность между ними позволяет судить об устойчивости органических примесей к действию окислителей. При определении окисляемости обоих видов происходит окисление не только содержащихся в воде органических веществ, но и некоторых неорганических, например закисного железа, сероводорода, нитритов. Поэтому следует еще раз подчеркнуть, что окисляемость характеризует содержание в воде органических веществ приближенно и условно.
Окисляемость чистых грунтовых вод составляет обычно 1–3 мг О2/дм3, в то время как в водах поверхностных источников окисляемость повышается до
10–12 мг О2/дм3. Реки болотного происхождения и поверхностные источники в
период паводка отличаются очень высокой окисляемостью, превышающей, например, 30 мг О2/дм3. Сточные воды, содержащие органические вещества и сбрасываемые в водоемы, могут повышать окисляемость воды различных источников.
Для суммарной оценки органических загрязнителей применяют метод сорбции из воды органических веществ активированным углем с последующим его высушиванием и экстракцией из него этих веществ хлороформом (метод угольно- хлороформного экстракта). В массовых единицах (мг/дм3) оценивают в ряде случаев содержание общего органического углерода в воде.
Для сопоставления показателей качества воды в табл. 1.3 дан ориентировочный химический состав вод некоторых источников водоснабжения.
1.7. Биологические показатели качества воды
В некоторых случаях химикам-теплоэнергетикам приходится готовить воду так называемого питьевого качества для систем открытого горячего водоснабжения либо использовать для водоснабжения и сброса стоков котельных, ТЭС в открытые водоемы, служащие также и для питьевого водоснабжения, в связи с чем необходимо иметь представления о некоторых биологических качествах воды.
Вода – среда для развития многочисленных форм вирусов, бактерий, простейших и сложных организмов. К числу бактериальных вирусных водных инфекций относятся дизентерия, брюшной тиф, холера, полиомиелит, бруцеллез и др.
Для определения чистоты воды в качестве критерия выбрана кишечная палочка. Кишечная палочка отмирает в воде медленнее многих болезнетворных бактерий, поэтому уничтожение кишечных палочек в процессе обеззараживания воды гарантирует в значительной мере отсутствие болезнетворных бактерий. Количество кишечных палочек в воде выражается коли-титром (к-т), т.е. тем объемом воды в 1 см3, в котором содержится одна кишечная палочка, или коли-индексом (к-и) – количеством кишечных палочек в 1 дм3 воды. Согласно ГОСТ для питьевой воды, коли-титр должен быть не менее 300 (или коли-индекс не более 3). Запах и вкус оцениваются количественно по пятибалльной системе.
Контрольные вопросы
1. Из каких этапов состоят круговороты природных и производственно-бытовых вод?
2. Какие основные катионы и анионы поступают в природные воды и за счет чего?
3. В чем качественное отличие поверхностных и подземных вод?
4. Какие признаки лежат в основе различных классификаций природных вод?
5. Каковы причины строгого нормирования содержания ионов Са2+ и Mg2+ в водах теплоэнергетических установок?
6. Какие показатели воды относятся к качественным и технологическим?
7. Какие виды жесткости и щелочности воды вам известны?
8. Почему окисляемость является условным показателем?
9. Поясните понятие коли-индекса?
Глава вторая
Дата добавления: 2017-03-12; просмотров: 7405;











