Термодинамические системы. Термодинамическое равновесие. Температура
Термодинамической системой будем называть одно или несколько макроскопических тел, выделяемых по какому-либо признаку. Ключевое слово здесь – макроскопические, т.е. содержащие огромное число молекул (например, в 1 см3 газа при нормальных условиях содержится примерно 2,7×1019 молекул). Единицей измерения количества частиц в системе является моль.
В одном моле содержится столько молекул (или каких-либо других структурных элементов), сколько атомов содержится в 0,012 кг изотопа углерода 12С. Число молекул в моле называется числом Авогадро NA = 6,022×1023 моль-1.
Системы могут взаимодействовать между собой и с другими телами (внешней средой), обмениваясь веществом и энергией.
Система, не обменивающаяся веществом и энергией с окружающей средой, называется изолированной (или замкнутой) системой.
Система, которая может обмениваться с окружающей средой только энергией (но не веществом), называется закрытой системой.
Система, обменивающаяся с окружающей средой и веществом, и энергией, называется открытой системой.
Если система состоит из частиц, движение которых с достаточной точностью может быть описано законами классической механики, её называют классической. Если же поведение составляющих систему частиц может быть описано только уравнениями квантовой механики, то такая система называется квантовой. Мы будем рассматривать главным образом классические системы.
Изолированная система является идеализацией и в действительности никогда точно не реализуется. Однако можно создать условия, при которых обмен энергией с другими телами станет пренебрежимо малым. Этого можно достигнуть путем заключения системы в твердую теплоизолирующую, или адиабатическую оболочку, т.е. такую оболочку, что состояние системы, помещенной внутри нее, не меняется при нагревании или охлаждении тел, находящихся вне оболочки.
Любая изолированная система со временем приходит в состояние термодинамического равновесия, в котором прекращаются все макроскопические процессы, давление и температура принимают постоянные по объёму системы значения. Данное утверждение является обобщением опыта и принимается в качестве постулата, который иногда называют общим началом термодинамики.
Любая термодинамическая система, находящаяся в неизменных внешних условиях, обязательно приходит в равновесие, т.е. в состояние, в котором она будет находиться сколь угодно долго.
Состояние равновесия является динамическим: на молекулярном (микроскопическом) уровне непрерывно происходят сложные движения, а на макроскопическом уровне не происходит никаких видимых изменений. При термодинамическом равновесии в системе прекращаются макроскопические механические движения, химические реакции, фазовые переходы, теплообмен между частями системы.
Если при приведении в тепловой контакт состояние термодинамических систем не меняется, то системы находятся в тепловом равновесии друг с другом и имеют одинаковые температуры. Тепловой контакт систем с разной температурой сопровождается передачей энергии от тела более нагретого (с большей температурой) к телу менее нагретому (с меньшей температурой).
Опыт показывает, что тепловое равновесие транзитивно. Если система А находится в тепловом равновесии с системой С, и система В находится в равновесии с системой С, то системы А и В находятся в тепловом равновесии друг с другом. Данное положение называют нулевым началом термодинамики. Благодаря этому мы можем судить о состоянии теплового равновесия рассматриваемых систем, не приводя их в непосредственный тепловой контакт, а пользуясь третьим телом – термометром.
При создании термометров используется тот факт, что практически все свойства тел в той или иной степени зависят от температуры. При нагревании подавляющее большинство тел расширяются, т.е. увеличивается их объем. Электрическое сопротивление металлов возрастает с повышением температуры, а полупроводников убывает. Если две проволоки из разнородных металлов спаять своими концами, то они образуют термопару. При нагревании или охлаждении одного из спаев в цепи возникает термоэлектрический ток, тем больший, чем больше разность температур спаев.
Для количественного определения температуры используется некоторое термометрическое тело, т.е. объект, изменение какого-либо свойства которого (термометрического свойства или термометрической величины) по соглашению связывается с температурой. Примером такого термометрического тела может служить ртуть в обычном термометре. Состояния, в которые приходит термометр, находящийся один раз в контакте с тающим льдом, а другой раз – с кипящей при нормальном давлении водой, принимаются соответствующими 0°С и 100°С соответственно (температурные точки). Индикатором температуры служит уровень жидкости в термометре, т.е. термометрической величиной является объем. Далее предполагается равномерность изменения объёма (уровня) жидкости при изменении температуры. Так получается эмпирическая температурная шкала Цельсия. Используя температурные точки, т.е. неизменные, хорошо воспроизводимые температуры, можно строить разные эмпирические температурные шкалы. В зависимости от выбора термометрического тела и термометрической величины можно осуществить бесконечное множество эмпирических температурных шкал. Они будут совпадать между собой, вообще говоря, только в основных (реперных) точках, принятых при построении шкал. Различные термометры, например ртутный и спиртовой, отградуированные по шкале Цельсия, дадут точно совпадающие показания только при 0°С и 100°С. В остальных случаях, при измерении температуры одного и того же тела, они будут давать близкие, но разные показания. Для устранения возникающей неоднозначности следовало бы принять какой-либо термометр за основной и по нему градуировать все остальные термометры.
При выборе основного термометра можно воспользоваться тем обстоятельством, что разряженные газы достаточно близки по своим свойствам к идеальным газам. Они с большой точностью подчиняются закону Бойля-Мариотта: произведение объёма V данной массы газа на его давление Р зависит только от температуры Т. Произведение PV можно принять за термометрическую величину, а сам газ – за термометрическое тело. Таким путем приходят к идеально-газовой шкале температур, которой мы будем пользоваться в дальнейшем. Она основана на уравнении состояния идеального газа (уравнении Клапейрона-Менделеева):
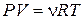 , (1.1)
, (1.1)
где n - число молей газа, R – универсальная газовая постоянная (R = 8,31 Дж/(моль×К)).
Уравнение (1.1), переписанное в виде 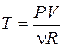 , можно рассматривать в качестве определения температуры. Далее надо взять некоторую массу газа, близкого по свойствам к идеальному, выбрать опорную – так называемую реперную точку, приписать этой точке некую температуру Т0, и измерить P0V0. Теперь, измеряя в некоторых условиях PV, будем считать температуру равной
, можно рассматривать в качестве определения температуры. Далее надо взять некоторую массу газа, близкого по свойствам к идеальному, выбрать опорную – так называемую реперную точку, приписать этой точке некую температуру Т0, и измерить P0V0. Теперь, измеряя в некоторых условиях PV, будем считать температуру равной 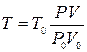 .
.
В качестве опорной температуры принята температура тройной точки воды, при которой находятся в равновесии лед, вода и водяные пары. В наиболее распространенной шкале Кельвина этой точке приписана температура Т0 = 273,16 К. Шкалы Кельвина и Цельсия связаны соотношением Т = 273,15 + t°C.
Преимущество идеально-газовой шкалы температур перед другими эмпирическими температурными шкалами состоит в том, что, как показывает опыт, температура Т, определенная в соответствии с формулой (1.1), очень слабо зависит от химической природы газа, которым наполнен резервуар газового термометра. Индикатором температуры в газовом термометре является давление газа при постоянном объеме резервуара.
Устройство газовых термометров и работа с ними довольно сложны – они имеют большие размеры, громоздки и медленно приходят в состояние теплового равновесия. Основное назначение газовых (первичных) термометров состоит в том, что по ним градуируются другие (вторичные) термометры. Наиболее распространенными вторичными термометрами являются жидкостные (главным образом ртутные) термометры, термометры сопротивления и термоэлементы.
Идеально-газовая шкала температур не может быть признана вполне удовлетворительной. Идеальных газов, строго говоря, не существует. Газовые термометры, наполненные различными газами, дают хотя и близкие, но все же не вполне совпадающие показания. При высоких температурах (~1000 К) молекулы многоатомных газов начинают распадаться на атомы, при еще больших температурах атомы ионизируются. Из-за этого газы перестают подчиняться уравнению Клапейрона-Менделеева, даже если их степень разряжения сколь угодно велика. При очень низких температурах реальные газы конденсируются в жидкость.
Рациональная температурная шкала не должна зависеть от индивидуальных свойств термометрического вещества. Она должна строиться так, чтобы в принципе можно было измерять любые температуры, как бы высоки или низки они ни были. Этим требованиям удовлетворяет абсолютная термодинамическая шкала температур, построенная на основе второго начала термодинамики. Ее также называют шкалой Кельвина. С ней мы подробно познакомимся в § 11.
В той области температур, где пригоден газовый термометр (от 4 до 1400 К), шкала Кельвина практически не отличается от идеально-газовой.
Дата добавления: 2017-03-12; просмотров: 3412;











