Связь модулей объемной упругости с теплоемкостями
Модуль объемной упругости К, также называемый модулем всестороннего сжатия, показывает, насколько сильно меняется давление при изменении объема. Он является коэффициентом пропорциональности, связывающим изменение давления и относительное изменение объема
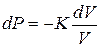 .
.
Так как давление зависит не только от объема, но и от температуры, K определяется не только веществом, но и условиями сжатия. Наиболее важными являются адиабатический Kад и изотермический КТ модули объемной упругости. Они определяются соотношениями
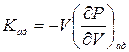 и
и 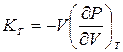 .
.
В предыдущем параграфе было показано, что для идеального газа
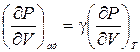 .
.
Отсюда следует, что Kад = g KТ. Покажем, что такое соотношение между адиабатическим и изотермическим модулями объемной упругости имеет место не только для идеального газа, но и для любого однородного и изотропного вещества. При выводе будем пользоваться фактом существования уравнения состояния (не зная его конкретного вида) и первым началом термодинамики
f(P,V,T) = 0,
dQ = dU + PdV.
Запишем первое начало термодинамики для адиабатического (dQ = 0) процесса
dU + PdV = 0.
Рассматривая внутреннюю энергию как функцию температуры и объема U=U(T,V), возьмем ее полный дифференциал
dU = (¶U/¶T)V dT + (¶U/¶V)T dV
и подставим в предыдущее выражение. Учитывая, что (¶U/¶T)V = CV получим
CV dT + [(¶U/¶V)T + P]dV = 0.
Из соотношения (4.6) следует, что выражение в квадратных скобках равно (Cp – CV)(¶T/¶V)P.
Тогда
CV dT + (CP – CV)(¶T/¶V)P dV = 0. (7.1)
Напомним, что рассматривается адиабатический процесс, и приращения dV и dT связывают температуру и объем на адиабате. Обозначая, как обычно, СР/СV = g, можно эту связь представить в виде
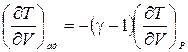 . (7.2)
. (7.2)
Соотношение (7.2) в каких-то ситуациях может оказаться весьма полезным, но сейчас нас интересует связь давления с объемом.
Рассматривая температуру как функцию давления и объема T = T(P,V), возьмем ее полный дифференциал dT = (¶T/¶P)V dP + (¶T/¶V)P dV и подставим в уравнение (7.1). После упрощений получим
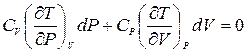 ,
,
или 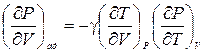 .
.
Воспользовавшись тождеством (2.4) легко убедиться, что (¶T/¶V)P(¶P/¶T)V = - (¶P/¶V)T.
Окончательно получим 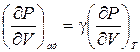 .
.
Значит Kад = g KТ для любого однородного и изотропного вещества.
Дата добавления: 2017-03-12; просмотров: 2292;











