Пересадка селезенки.
ИСТОРИЯ РАЗВИТИЯ ТРАНСПЛАНТОЛОГИИ. ПЕРЕСАДКА ЖИЗНЕННО ВАЖНЫХ ОРГАНОВ
Наука о пересадке жизненно важных органов называется трансплантологией.Трансплантология как наука сформировалась примерно 150 лет назад, хотя пластические операции были известны уже в течение нескольких столетий.
Мечта о замене органов и тканей, необратимо поврежденных в результате травмы или заболевания, и о возвращении людям здоровья, зародилась еще на заре человечества. Но только в ХХ столетии проблема трансплантации органов и тканей перестала быть плодом фантазии писателей и ученых и по настоящему перешла из разряда искусства в один из реальных способов восстановления здоровья человека.
Трансплантация тканей – ятрогенное действие, не имеющее естественных аналогов в природе. Тем не менее, в медицинских целях трансплантацию производят не так уж редко. Например, в США в 1992 г. было сделано почти 10 000 пересадок почек (80% не отторглись в течение 5 лет), 3 000 пересадок печени (40% не отторглись в течение 5 лет), 2 000 пересадок сердца (70% не отторглись в течение 5 лет), 500 пересадок легкого (30% не отторглись в течение 5 лет), много, но неучтенных, пересадок костного мозга (80% не отторглись в течение 5 лет). Но эти цифры не нужно принимать как большой успех в победе над природой. Трансплантация производится по жизненным показаниям, когда другого способа продлить жизнь человеку нет.
Пересадка органов - это не только исследование тайн природы, таких как сущность белковой специфичности и ее последствия (отторжение чужеродных органов и тканей), для изыскания возможностей замены частей человеческого тела, утративших свою структуру и функцию, но и ценный метод физиологического и биологического исследования. При операциях такого рода создаются уникальные условия временной изоляции органа от важнейших систем жизнеобеспечения организма (кровеносной, нервной, лимфатической и др.). Появляется возможность исследования механизмов управления различными параметрами гомеостаза, познания их биологической сущности.
В последние годы прогресс хирургической техники достиг такого уровня, что практически любой орган может быть пересажен в эксперименте не только у крупных лабораторных животных, но и у мелких. Однако в клинике спорными остаются некоторые технические моменты в связи с их физиологическим значением. Важнейшей в области трансплантологии остается проблема биологической несовместимости, а также вопросы, связанные с обеспечением адекватных условий функционирования трансплантатов. Как справедливо заметил Ф. Мур (1973), история пересадок тканей - это история борьбы с отторжением.
Пересадка почки.
В медицинской литературе впервые упоминается о пересадке почки в эксперименте 24 января 1902 г. В одном из венских журналов была опубликована статья Ульманна "Пересадка почки". В ней Ульманн упоминает о проведенных им ранее экспериментах по пересадке кишечника и других органов. Он описывает пересадку почки у собаки с ее обычного места на шею посредством анастомоза почечной и сонной артерий. В следующей заметке в том же журнале он сообщает о пересадке почки от собаки к собаке, а позже от собаки к козе, которую он продемонстрировал на заседании хирургического общества 27 июня 1902 г. Далее эксперименты по пересадке почек продолжил Алексис Каррель, родившийся во Франции в 1873 г. Переехав в 1904 г. в Чикаго (США), он провел в местном университете первые эксперименты по пересадке почек. В 1910 г. Каррель обобщил все свои соображения о пересадках почек, сфокусировав свое внимание на центральной проблеме различий между алло- и аутотрансплантациями. Он подчеркивал, что изменения, происходящие в пересаженном органе при аллотрансплантации, вызваны влиянием организма реципиента, т.е. биологическими факторами. Однако объяснить действие этих факторов он не мог.
В 1923 г. Уильямсон сообщил о феномене, над которым бился Каррель: пересадка почки от одного животного к другому вызывала реакцию, в корне отличную от той, что имела место при перемещении почки внутри одного и того же организма. Только в 1960 г. стало ясно, что огромное значение при аллотрансплантациях имеет совместимость групп крови. Идеи ученых о типах и группах тканей начали осуществляться только в 1963 г. с появлением тестов на тканевую совместимость. Однако, еще в 1953 г. Биллингем, Брент и Медавар описали "активно приобретенную толерантность". В работах датского ученого из Копенгагена Симонсена (1953) впервые было показано, что явления, наблюдаемые у собак с пересаженными почками, вызваны иммунной реакцией отторжения и объяснимы в свете исследований Медавара (относящихся к пересадкам кожи мышей). В организме реципиента образуются антитела против индивидуально-специфических антигенов трансплантата.
Пересадки органов и тканей активизировались после второй мировой войны. На первую пересадку почки от трупа при остром канальцевом некрозе отважился хирург Чарльз Хафнейгель в 1947 г. Почка была пересажена на артерию и вену в области передней локтевой ямки. Почка начала выделять мочу и на следующий день у пациентки появились признаки заметного улучшения. Она полностью пришла в сознание. Однако через сутки мочеотделение заметно уменьшилось и почку пришлось удалить. Но состояние пациентки было вне опасности и она начала поправляться.
11 февраля 1953 г. после двух подготовительных операций по формированию кожного кармана, который прикрыл бы пересаженный орган, на правое бедро больного Дж.У. 26 лет по профессии врача-терапевта, была пересажена почка. Операцию выполнили врачи из США Хьюм, Торн и Меррил. Эта почка была взята у молодой женщины, умершей во время операции на сердце. Группы крови донора и реципиента были совместимы. При пересадке почку поместили в тонкий полиэтиленовый мешочек - врачи надеялись тем самым помешать антигенам почки добраться до клеток реципиента, вырабатывающих антитела. Ишемия длилась 3 часа. Вначале трансплантат не выделял мочи. На 19 -й день после операции содержание мочевины в крови в 10 раз превышало норму. Но на следующий день картина резко изменилась. Почка начала выделять мочу, на 25 -й день ее количество достигало 400 мл в сутки, а на 37- й день почка выделила за сутки 1000 мл светлой мочи. На протяжении последующих шести месяцев диурез установился на уровне 1000 - 3000 мл ежедневно. На 81- й день после операции больной выписался из больницы, став первым в мире человеком, чья жизнь поддерживалась исключительно благодаря функционированию почки, пересаженной от другого человека. Но через 5 месяцев и 25 дней больной неожиданно умер. Исследование трансплантата на вскрытии показало, что из-за крайне высокого давления крови артерии подверглись атеросклеротическим изменениям. Реакции отторжения трансплантата не было.
Всего к концу 1953 г. было выполнено 15 пересадок почки. Однако ни в одном случае о выздоровлении не было речи. На этом закончилась первая серия пересадок почек без применения иммунодепрессантов и лучевой терапии. Несмотря на неудачи в результате этих операций были получены ценные данные по хирургии и иммунологии, они явились прологом настоящих достижений науки.
23 декабря 1954 г. хирург Муррей, ученик Хьюма, сделал пересадку почки от здорового близнеца его больному брату. Пересаженная почка была помещена вблизи больной почки, соединена с почечными сосудами, а мочеточник выведен в мочевой пузырь. После операции больной стал быстро поправляться. Через месяц больной был на пути к выздоровлению. Но кровяное давление больного не вернулось к норме, так как оставались обе больные почки, совсем не вырабатывающие мочи. Они были удалены, на 6- й месяц наступило полное выздоровление.
К концу 1963 года во всем мире было осуществлено около 30 пересадок между однояйцовыми близнецами, а к январю 1970 г. их число достигло 49.
В 1957 - 1959 годах усилия ряда американских ученых были направлены на разработку методов иммунодепрессии у животных с помощью общего облучения. Один из шести клинических случаев оказался удачным. Успех послужил толчком к дальнейшим исследованиям и позволил сделать важные выводы. Необходимое равновесие выживания было достигнуто за счет уменьшенной дозы облучения при близком генетическом родстве донора и реципиента (разнояйцовые близнецы). Больной выжил. Так была осуществлена первая в истории успешная аллотрансплантация почки между людьми, не являющимися однояйцовыми близнецами. 17 января 1960 г. была проведена успешная пересадка почки во Франции хирургом Кюссом больному 41 года от сестры. Больного также предварительно подвергли общему облучению. В последующие несколько лет французские хирурги Амбюрже и Кюсс провели наибольшее количество пересадок. Амбюрже сообщил о 25 проведенных им аллотрансплантациях, во время которых для иммунодепрессии использовалось общее облучение. В 12 случаях донорами почки были матери пациентов, в 9-ти - братья или сестры. Из 25 пациентов семеро были живы 3 года спустя, двое умерли, прожив после операции 22 месяца, и двое жили свыше 2 лет. К этому периоду интенсивно стали изучать антитела, образующиеся у человека в ответ на инъекцию лейкоцитов от постороннего лица. Эти исследования со временем привели к разработке так называемого "лейкоцитарного теста" и тканевому типированию. Французы продолжали успешную работу на основе лейкоцитарных групп и в 1962 г. впервые успешно пересадили больному почку от двоюродного брата. Вслед за этими французские хирурги осуществили блестящие серии пересадок безнадежно больным пациентам, вернув их к нормальной жизни с помощью трансплантации почки.
Одной из первых попыток повлиять на иммунологические реакции с помощью химических препаратов сообщил еще в 1916 г. Хэктун из Чикаго. Ему удалось показать, что иприт задерживает образование антител против чужеродных эритроцитов, вводимых в кровь кролика. В 1959 г. были опубликованы исследования Шварца и Демшека (США) о получении "иммунологической толерантности, вызванной введением лекарств", или иммунодепрессии химическими препаратами. С этой целью они использовали 6-меркаптопурин, который ранее применялся при лечении рака. Реакцию "трансплантат против хозяина" можно блокировать введением другого противоопухолевого препарата аметоптерина (Апхофф, 1958), азатиоприна, азасерина, актиномицина, кортизона и др. К середине 1961 г. было установлено, что иммунодепрессия гораздо легче достигается с помощью химических препаратов, чем общим облучением.
В 1963 г. в Бостоне был заведен Международный регистр пересадок почки человеку, который ведется консультативным комитетом, где представлены данные из многих лечебных учреждений США, Европы, Австралии, Новой Зеландии. Благодаря современным методам вычислительной техники ведется непрерывный сбор информации, и ежегодно публикуются данные о пересадках почек во всем мире.
Уже к январю 1971 г. было зарегистрировано 4683 пересадки, около 2% пересадок (примерно 90 случаев) произведены между близнецами. В 52% всех пересадок трансплантат был взят от неродственного донора, чаще всего от трупа. Живые неродственные доноры составляют всего 1,5%. В 46% случаев донорами были члены семьи. Как показывают данные, когда донорами являются братья и сестры, вероятность нормального функционирования почки в течение года составляет 91%; если это родители - 83%, другие кровные родственники - 67%; при использовании почки от трупа - 42%.
Благодаря внедрению типирования по HLA-DR антигенам, использованию защитного действия переливания крови и применению нового иммунодепрессора циклоспорина А, значительно возросло число длительно функционирующих почечных трансплантатов. Эти успехи, в свою очередь, явились стимулом для более широкого использования трансплантации сердца, печени, поджелудочной железы.
Пересадка печени.
Печень была следующим после почки органом, который стал объектом аллотрансплантации. В 1955 - 1965 гг. проводились широкие лабораторные исследования на собаках. В 1963 - 1970 гг. были предприняты попытки пересадки печени от человека человеку, но безуспешно. Поскольку печень орган непарный, использовать можно только трансплантат от трупа. Пересадки печени начались как естественное продолжение пересадок почки, но привлекли гораздо меньше внимания ученых и общественности и оказались самыми трудными, самыми рискованными и самыми безуспешными из всех трансплантаций органов. В отличие от других органов печень крупный орган, в 10 раз превышающий почку по размеру, а ее кровеносные сосуды представляют сложную сеть капилляров, принимающих кровь от кишечника.
Приоритет в экспериментальных пересадках печени собакам принадлежит C.S. Welch et al. (1955) из медицинского института им. Тафта. В середине 50-х годов его лаборатория занималась этими проблемами и опубликовала статьи о самых различных типах пересадки печени. Уже самые первые лабораторные исследования показали, что печень можно переместить от одной собаки к другой; при этом иммунная защита достаточно сильна, чтобы вызвать отторжение, сходное с аналогичным явлением при пересадке почки. Новая печень некоторое время успешно функционировала, полностью выполняя свои функции. К осени 1960 г. стало очевидно, что печень собаки можно удалить, а на ее место подшить новую. При этом трансплантат будет выполнять свои функции неукоснительно пока не будет отторгнут. При первых пересадках печени самой важной хирургической проблемой была проблема с воротной веной, несущей кровь от кишечника, богатую питательными веществами. Во время трансплантации ее пересекают и надо создать обходной канал для нормального кровотока к сердцу. Что касается отторжения, то к 1961 г. стало ясно, что химические иммунодепрессанты, применяемые при пересадках почки, могут с таким же успехом использоваться и при пересадке печени. Отторжение печени (примерно на десятый день) очень сходно с процессом, наблюдаемым у больных, страдающих холангиолитическим гепатитом. Это тоже желтуха в результате застоя желчи в малых протоках внутри печени; в большей степени поражается "воротная триада". При инфильтрации лимфоцитами и интенсивной воспалительной реакции в этой области печень лишена возможности нормально экскретировать желчь. Происходит закупорка малых желчных протоков, называемая "внутрипеченочной холестатической желтухой". Столь поразительное сходство гистологической картины навело на мысль, что при этом заболевании также присутствует иммунный компонент - в данном случае самоотторжение или аутоиммунный процесс. В последствии отторгаемую печень наводняют лимфоциты, кровоток останавливается, и отдельные участки печени инфицируются. Эти первые едва заметные изменения впоследствии совершенно заслоняются обширными изменениями при далеко зашедшем отторжении.
В 1955 г. C. S. Welch et al. предложили и осуществили гетеротопическую трансплантацию дополнительной печени. В 1959 г. F. D. Moore, а в 1960 г. T. E. Starzl предложили и осуществили ортотопическую пересадку печени (после удаления собственной в случае аллогенного варианта). Первую ортотопическую пересадку печени человеку произвел T. E. Starzl в 1963г.
|
|
|
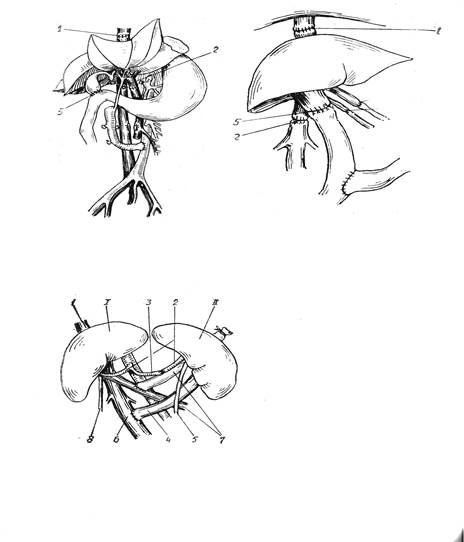
Рис. 1.1. Схема ортотопической пересадки печени: а – по T.E. Starzl (1960), б – по Э.И. Гальперину (1978); в- схема гетеротопической пересадки печени по Hadgihara, K.B. Absolon (1964).
В течение 1963 г. было предпринято 6 попыток пересадить печень человеку. Ни одна из них не увенчалась успехом. Истории этих больных свидетельствуют о том, что при пересадке печени возникает ряд проблем, многие из которых не решены и по сей день.
Первым в США, кому попытались пересадить печень, был Дж. Б., 58 лет, строительный рабочий, здоровый, несмотря на увеличенную печень. Он не был желтушен, не терял в весе. Рентгеновское исследование показало наличие первичной гепатомы, проросшей всю печень. Операция была проведена 16 сентября 1963 г. Донором стал молодой полицейский, погибший от ранения головы. После сложной шестичасовой операции состояние больного ободряло. Печень в первое время функционировала настолько хорошо, что не оставалось сомнения относительно нормального кровоснабжения. Печень выполняла свои функции. Через два дня состояние больного ухудшилось, начала развиваться инфекция. Дозы иммунодепрессантов были высоки, т.к. группы крови донора и реципиента не совпадали. На 11 день больной скончался от инфекции в печени и легких. Вскрытие показало главную причину неудачи: значительная часть печени была обескровлена, вероятно, из-за длительного предсмертного шока у донора. Кроме того, в кишечнике обнаружилась небольшая раковая опухоль. Таким образом, опухоль в печени была метастазом, а не первичной гепатомой, как предполагали.
С марта по октябрь 1963 г. денверская группа Штарцля провела пять пересадок печени человеку. Максимальный срок выживания 23 дня. Причиной смерти служили инфекция, легочные тромбозы. После этих безуспешных опытов клиническая деятельность по пересадке печени на несколько лет замерла, зато с новой силой вспыхнули лабораторные исследования. В 1963 - 1964 гг. многие европейские лаборатории почти одновременно занялись трансплантацией печени.
Вскоре E. Norman, T. Mac Donald et al. показали в эксперименте возможности лечения печеночной недостаточности временным гетеротопическим подключением чужеродной печени. Первая гетеротопическая пересадка у человека осуществлена K.B.Absolon et al. в 1965 г. В 1965 г. B.Eiseman et al., T.E.Starzl et al., в СССР Ф.Б.Балюзек, Б.А.Петров (1967), затем во Франции L. Leger (1969) произвели эту операцию с использованием печени человека или животных (свиньи, обезьяны) для лечения больных в состоянии печеночной комы.
В 1962 г. B.Sigel, затем другими исследователями, в том числе и советскими учеными, были предложены модели сегментарной пересадки печени, выполняемые как в ортотопическом, так и в гетеротопическом варианте.
Таким образом, в середине 60-х годов были созданы и применены в эксперименте и в клинике главные модели пересадки печени на сосудистой ножке. Далее модели пересадки печени в различных вариантах были разработаны в эксперименте для животных: собак, свиней, крыс, обезьян. Предложено много вариантов ортотопической пересадки печени и особенно гетеротопического подключения органа или части его к сосудам брюшной полости и таза, а также к бедренным сосудам и сосудам шеи. Усовершенствованы методы экспериментального временного подключения алло- и ксеногенной печени больному с печеночной комой. Наконец, разработана и внедрена в хирургическую практику гемосорбция (искусственная печень).
К 1967 г. химические иммунодепрессанты, особенно азатиоприн, были использованы почти при 1000 пересадок почек. Экспериментальные пересадки печени значительно прогрессировали, некоторые животные жили в лаборатории несколько месяцев с одной только аллотрансплантированной печенью. Антилимфоцитарная сыворотка стала доступной, а простой насос для перфузии охлажденной печени донора дал хирургам несколько лишних часов на приготовления.
Весной 1967 г. клиническая деятельность снова возобновилась. К 1969 г. в мире была осуществлена 91 пересадка печени, из них примерно треть по поводу атрезии желчных протоков, треть - по поводу рака и треть по - поводу всех других заболеваний, включая травмы и цирроз. Дольше всех жили больные из числа 25 пациентов, оперированных в Денвере Штарцлем. Его самый выдающийся долгожитель - двухлетний ребенок с атрезией желчных протоков. Два года спустя он чувствовал себя хорошо и стал рекордсменом среди всех людей с пересаженной печенью. Всего из 25 пациентов Штарцля год и больше прожили шестеро. К октябрю 1970 г. было произведено 133 пересадки печени, выжили 12 пациентов, самый большой срок жизни - 29 месяцев.
Как выяснилось из этих опытов, лечить гепатому пересадками нецелесообразно. У всех пяти больных гепатомой, проживших после операции свыше 2 месяцев, рецидивировал рак, который и стал непосредственной причиной смерти.
О второй крупной серии пересадок печени сообщил Кэлн (Англия): 14 случаев, из них 12 - ортотопическая пересадка, 2 - вспомогательная печень в гетеротопическом положении. Группа врачей из Брайэмской больницы сделали 4 пересадки печени. Ни один из пациентов не прожил дольше 7 недель.
Одной из самых подготовленных бригад трансплантологов, специализированных по пересадке печени, T.E.Starzl et al. (США), с 1963 до 1980 г. было оперировано 170 больных. Из них 19% жили дольше года и 29 человек - дольше 5 лет. За 4 последующих года ими был прооперирован 191 больной, при этом процент больных, живших дольше года, приближался к тому, что имеется при пересадке почки, т.е. от 64% до 80% (по данным 10-го Международного конгресса трансплантологов, состоявшегося в 1984 г. в г. Миннеаполисе). Значительное количество больных дважды успешно подвергались трансплантации печени.
В СССР наибольшим опытом ортотопической и гетеротопической трансплантации целой печени и ее долей в эксперименте располагают В.И. Шумаков, Э.И. Гальперин и сотр. (1972-1981); первая ортотопическая пересадка печени у человека была осуществлена во Всесоюзном научном центре хирургии 14 февраля 1990 г.
Во всем мире пересадка печени проводится в 10 центрах, в которых работают кооперации высококвалифицированных хирургов с гепатологами, иммунологами, морфологами, клиническими фармакологами. Это обеспечивает оптимальное выхаживание, последующее наблюдение за больными и способствует дальнейшей разработке методов пересадки.
Интересными являются попытки использовать в качестве трансплантатов печень от плодов и новорожденных. Результаты исследований в этом направлении открывают определенные перспективы, поскольку размеры печени плода или новорожденного небольшие, следовательно, пригодны для пересадки даже детям. По физиологическим свойствам они отличаются от взрослых трансплантатов большими регенерационными способностями и адаптационными возможностями. Они обладают стимулирующими свойствами на собственные органы, в частности, на печень реципиента.
В конце 70-х годов был предложен способ изоляции гепатоцитов (Cavallero A. et al., 1973). Гепатоциты могут быть использованы в свежем виде, без консервации, или могут предварительно подвергаться консервации в соответствующих питательных средах при пониженной температуре в присутствии криопротекторов. Гепатоциты могут также культивироваться in vitro. В качестве источника клеток могут быть использованы органы от взрослого животного или от плода.
Ткань и клетки печени вводятся в организм реципиента разными способами: подкожно, внутрибрюшинно, под капсулу почки или селезенки, в печень через пупочную вену или прямо под капсулу органа. Имплантация гепатоцитов применяется, главным образом в эксперименте, для решения ряда теоретических вопросов, таких, как определение их функциональных способностей (могут ли одни гепатоциты корригировать печеночную недостаточность, вызванную либо ишемией органа, либо токсическими воздействиями), уточнение их антигенной характеристики и способности вызывать иммунные реакции.
В клинике культуры гепатоцитов ксеногенного происхождения используются в некоторых аппаратах для гемосорбции. Печеночные клетки также вводятся человеку внутривенно, внутрибрюшинно и в толщу прямых мышц живота для коррекции некоторых врожденных расстройств метаболизма и иммунной системы. В определенном проценте случаев (до 50%) удается получить длительные ремиссии заболевания. Имплантация клеток фетальной печени приравнивается по эффекту к трансплантации костного мозга, но выгодно отличается от последней тем, что не вызывает реакции трансплантата против реципиента.
Таким образом, с хирургической точки зрения пересадить печень гораздо труднее, чем почки или сердце. Основная проблема - это восстановление кровообращения в трансплантированной печени. Наиболее частыми осложнениями после пересадок, кроме отторжения, являются кровотечения, тромбозы и инфекция. Эти осложнения в сочетании с низкой выживаемостью пациентов, особенно при гепатоме, делают пересадку печени клинической редкостью. Однако потребность в этой операции огромная. Только пересадкой можно спасти больного с первичной гепатомой, с запущенным циррозом или ребенка с атрезией желчных протоков. Показаниями к пересадке печени являются также первичный склерозирующий холангит, хронический активный гепатит с переходом в цирроз печени и начинающейся печеночной недостаточностью, первичный и вторичный билиарный цирроз, врожденные нарушения обмена веществ - альфа-1-антитрипсиновая недостаточность, болезнь Вильсона-Коновалова, врожденный фиброз печени, порфирия, гемохроматоз, галактоземия, тирозинемия, гликогенозы. Для врачей и хирургов-трансплантологов печень остается величайшим вызовом во всей трансплантационной хирургии; для пациентов, чья печень - первичный очаг смертельной болезни, это поистине единственная надежда на спасение.
Усовершенствование методики операции, иммуносупрессивная терапия с использованием циклоспорина А или других (FK-506) и снижением дозы преднизолона значительно повысили выживаемость больных в ведущих центрах. В то время как в 1963-1977 гг. лишь у 28% больных, наблюдаемых T.E. Starzl и соавт., продолжительность жизни составила свыше 1 года после пересадки печени, а в течение 3-9 лет в живых оставались 13% пациентов, в конце 80-х годов выживаемость свыше 1 года наблюдалась у 50% больных, а свыше 2,5 лет - у 43% больных. Менее оптимистичные результаты приводят R.Y.Calne и соавт. (1986), проводившие пересадку пациентам, среди которых до 49% составляли больные раком печени. P.Barbier (1986) сообщил о выживаемости после пересадки печени свыше 5 лет 60-70% взрослых реципиентов и 80% детей. Значительно лучшая выживаемость и большая продолжительность жизни отмечается при пересадках печени у детей.
Основными причинами смерти явились сепсис, желчная обструкция, кровотечения из желудочно-кишечного тракта, рецидив опухоли и реакция отторжения.
Перспективы дальнейшего развития проблемы пересадки печени заключаются в возможностях пролонгирования консервации органа с применением для этого новых консервантов (коллоидные растворы, коферменты, витамины), поиске специфических и щадящих иммунодепрессантов. Изучаются возможности применения моноклональных антител в комбинации с другими воздействиями.
Поскольку печень у человека тоже регенерирует, то становится возможным использование части печени от живых доноров для трансплантации (Rebecca Taub, 2004). Изучаются возможности пересадки отдельной доли или нескольких сегментов, использования печени новорожденных, плодов, что очень важно в педиатрии. Начинает применяться имплантация клеточных смесей печени или гепатоцитов. Пересадка печени имеет важное теоретическое значение как модель исследования процессов регенерации и адаптации на субклеточном, клеточном и органном уровне и для проникновения в сущность биологического конфликта между генетически разными особями - донором и реципиентом. Перспективны более ранние операции у больных с сохраненным функциональным резервом печени, что обеспечивает лучшую выживаемость. Определенные надежды возлагаются на внебрюшинную пересадку левой доли печени и гетеротопическую пересадку при острой печеночной недостаточности и врожденных ферментных дефектах.
Успехи молекулярной биологии и техники оперативного вмешательства способствуют прогрессу в трансплантации печени. К достижениям хирургической гепатологии следует отнести создание методик выключения печени из общего кровотока с аппаратным венозно-венозным ее шунтированием. Исследования, проводимые на молекулярном уровне, подтвердили, что применение гипотермии и использование растворов консервантов, например, Belzer’а или Bretschneider’а сохраняет печень жизнеспособной в течение длительного промежутка времени (8 – 12 часов).
К несомненным достижениям гепатологии следует также отнести и разработанную новую методику резекции печени с использованием экстракорпоральной перфузии, что позволило производить пересадки участков резицированной печени или ее долей нескольким реципиентам. R. Pichlmayer (1988) предложил методику резекции печени (так называемая аутотрансплантация) у больных раком печени. Применяемое экстракорпоральное шунтирование в условиях гипотермии позволяет выполнять эти крайне сложные резекции без нарушения кровотока по печеночным венам. Техника оперативного вмешательства идентична таковой при ортотопической аутотрансплантации печени: забор трансплантата, гипотермическая перфузия печени (температура раствора +4оС), резекция печени ex vivo (полностью извлекается из брюшной полости), включение неизмененных участков печени в системный кровоток. Однако существует два принципиальных отличия: во-первых, отсутствует аутоиммунный конфликт и, соответственно, отторжение трансплантата, во-вторых, пациент одновременно является и донором и реципиентом. Результаты четырех таких аутотрансплантаций опубликованы Е. Форни и Ф. Мериджи (Италия) в 1998 г. На основании своих исследований авторы считают, что удаление даже считавшихся ранее неудалимыми первичных и метастатических опухолей печени становится реальным.
По мнению Б.А. Константинова и С.В. Готье (1998), весьма перспективным является развитие программ родственной трансплантации печени детям и взрослым реципиентам с малыми антропометрическими параметрами. Они практически полностью лишены возможности получения донорской печени, поскольку Закон РФ не предусматривает диагностики смерти мозга у детей, а, соответственно, исключает получение трансплантатов малых размеров. Развитие указанного направления напрямую связано с совершенствованием резекционной хирургии печени, что обеспечит возможность безопасного взятия у живого донора значительных объемов печени для трансплантации близкому родственнику. Именно по такому пути развивается трансплантация печени в Японии, Турции, США, Германии. Дальнейшие исследования, как считают авторы, должны быть направлены на разработку способов формирования искусственного микрохимеризма, т.е. иммунологического сближения организма реципиента и донорского органа. В связи с этим большой интерес вызывают исследования в области создания популяций генетически трансформированных животных, в частности, трансгенных свиней, органы которых при трансплантации человеку не будут вызывать иммунного ответа. Этой же цели посвящены работы по клонированию органов и тканей, которые могут позволить частично или полностью решить проблему получения донорских органов и будут иммунологически программируемы.
Пересадка сердца.
Хирурги впервые вторглись в человеческое сердце во время второй мировой войны, чтобы удалить осколки, пули, а затем примерно в 1948 г. - для исправления клапанов сердца. Эти операции на вскрытом сердце потребовали найти новый способ поддержания жизни пациента. Этой цели удовлетворяет аппарат искусственного кровообращения (АИК) с оксигенатором крови, который может поддерживать кровообращение до 6 часов, необходимых для проведения операции.
В отличие от пересадок других органов,пересадки сердца начались без длительных лабораторных исследований. По чистой случайности с первыми пересадками сердца совпала разработка тестов на тканевую совместимость. Ф.Мур (1973) пишет "Для трансплантолога в пересадке сердца нет ничего нового. Его не удивляют многочисленные неудачи и не трогают случайные выдающиеся успехи. Для биолога же, работающего в других областях и относящегося в лучшем случае скептически к опытам хирургов или к клинической медицине в ее самых радикальных формах, пересадка сердца - всего лишь еще один печальный пример злоупотребления человеческими познаниями и разбазаривания общественных средств. Только выжившим больным и их семьям, да людям, ранее не слыхавшим о трансплантациях, пересадка сердца кажется самоновейшим медицинским чудом ".
В 1933 г.Манн с сотрудниками, работавший в научно-исследовательской лаборатории клиники Майо, сообщил о пересадке неповрежденного сердца млекопитающего. Ученых интересовала функция сердца при разъединении всех нервных связей. В 1953 г. Луизада и его чикагские коллеги сообщили о пересадке сердца подопытным животным; в том же году поступило сообщение от советского ученого Н.П.Синицына. Обе исследовательские группы рассматривали сердце как аллотрансплантат и интересовались, прежде всего, его функциональной способностью.
В 1960 г. Лоуэр и Шамуэй, сотрудники Стенфордского университета, сообщилио своих первых опытах по пересадке сердца собакам. Клиническое приложение этих опытов почти или вообще не предвиделось, ибо еще не были осознаны ни проблема донора, ни ее последствия в плане нового определения смерти. Тем не менее, первые пересадки сердца животным подтвердили ряд важных моментов. Во-первых, сердце можно удалить у одного животного и переместить его в организм другого. Во-вторых, методы экстракорпорального кровообращения могут быть непосредственно использованы при пересадках сердца, обеспечивая нормальное кровоснабжение мозга и жизненно важных органов в течение часа или большего срока, когда пациент вообще лишен сердца. В-третьих, после отключения аппарата искусственного кровообращения сердце в своем новом организме выполняет свою функцию в полном объеме. В-четвертых, сердце, полностью лишенное иннервации, функционирует нормально. Для постепенного восстановления иннервации пересаженного сердца требуются многие месяцы. В-пятых, электрический график работы сердца (электрокардиограмма) является точным указателем отторжения.
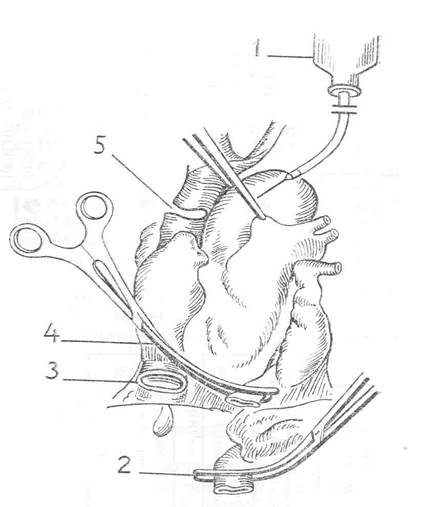
Рис. 1.2. Общий вид сердца перед его удалением:
1 – резервуар для перфузии кардиоплегического раствора в восходящую аорту; 2 – место пережатия брюшной аорты; 3 – рассеченная нижняя полая вена; 4 – зажим на грудной аорте; 5 – верхняя полая вена, скрепленная скобками и пересеченная.
В конце 1966 г. лишь немногие лаборатории занимались пересадками сердца. Одна такая лаборатория находилась в г. Кейптауне (ЮАР), где Кристиан Бернард занимался экспериментами по пересадке сердца. В 1968 г. 2 января он прооперировал больного по имени Филипп Блайберг, пересадив ему сердце от молодой девушки, погибшей в автокатастрофе. Это была настоящая сенсация. Ф. Блайберг прожил 19 месяцев спустя после операции. Скончался Блайберг от сердечной недостаточности, вызванной поражением коронарных сосудов. Перенеся эксперимент в клинику, К. Бернард положил начало неудержимой волне пересадок сердца во всем мире. Рекорд поставил американский хирург Норман Шамуей из Стенфордского университета в США. Он провел 70 операций по пересадке сердца, но все его больные погибли. После таких безуспешных попыток наступил период осознания и анализа причин отторжений трансплантатов. В 1972 г. в Англии даже был принят закон, запрещающий пересадки сердца. В СССР с самого начала к пересадкам сердца относились с осторожностью. В это время велись активные работы по созданию искусственного сердца и преодолению тканевой несовместимости, являющейся основной причиной отторжения трансплантата. Однако прожить на искусственном сердце можно не более 3 - 4 дней, далее необходима трансплантация. Но за этот небольшой период может быть найден подходящий донор.
К октябрю 1970 г. было произведено 167 пересадок сердца. В живых осталось 23 человека. Наибольшая продолжительность жизни больных - 26 месяцев после операции. К августу 1971 г. было произведено 175 пересадок сердца, после которых осталось в живых 27 человек. Донорами и реципиентами были люди разных рас и национальностей. В 106 случаях доноры были белыми, в 7 случаях - черными, остальные других рас. Реципиенты были белыми в 107 случаях, черными в 9, остальные - другой расы. Какой-либо зависимости продолжительности жизни реципиента от расовой принадлежности не отмечено. 86% доноров были мужчины, средний возраст - 29 лет. Причиной смерти была, в основном, травма мозга.
В настоящее время достигнуты большие успехи в пересадке сердца. Вместе с тем, хирурги пренебрегают принципом
Дата добавления: 2017-03-12; просмотров: 4857;











