Электрохимическая коррозия металлов. Виды электрохимической коррозии. Электрохимическая коррозия с кислородной и водородной деполяризацией
Электрохимическая коррозия сопровождается возникновением электрического тока и протекает в средах с хорошей ионной проводимостью. К электрохимической коррозии относится коррозия в водных растворах. Электрохимической коррозии подвергаются подводные части судов, паровые котлы, проложенные в земле трубопроводы. К электрохимической коррозии относится: коррозия в электролитах, атмосферная коррозия, электрокоррозия, коррозия под напряжением.
В результате электрохимической коррозии окисление металлов может приводить как к образованию нерастворимых продуктов (ржавчины), так и к переходу металла в раствор в виде ионов.
Растворенный кислород, ионы водорода, молекулы воды – это важнейшие окислители, вызывающие электрохимическую коррозию металлов.
Все металлы делят на пять групп по степени термодинамической устойчивости. Такое деление соответствует их положению в ряду напряжений.
К группе повышенной термодинамической нестабильности относятся металлы, имеющие значение стандартного электродного потенциала меньше, чем потенциал водородного электрода при рН = 7 (-0,413 В), а именно Li, Rb, Cs, Ba, Sr, Ca, Na, Mg, Al, Ti, Zr, Mn, Cr, Zn, Fe. Данные металлы могут коррозировать даже в нейтральных средах, то есть могут окисляться водой. Естественно эти металлы коррозируют и в кислых средах. Металлы могут окисляться кислотой, кислородом, а также под действием других окислителей, при этом протекает процесс, описываемый уравнением
M – ne- = Mne+ (10).
Процесс электрохимической коррозии – это совокупность двух процессов, одновременно протекающих на поверхности металла:
-анодного, сопровождающегося окислением атомов металла, протекающего по уравнению (10);
- катодного, сопровождающегося восстановлением окислителя коррозионной среды, протекающего по уравнению
Окисленная форма + ne- = Восстановленная форма (11).
Окислители электрохимической коррозии называют деполяризаторами. Приведем возможные процессы восстановления окислителей:
2Н2О + 2е- = 2ОН- + Н2 , φ = -0,413 В (рН = 7) (12)
2Н+ + 2е- = Н2, φ = 0 В (рН = 0) (13)
О2 + 2Н2О + 4е- = 4ОН-, φ = 0,816 В (рН = 7) (14)
О2 + 4Н+ + 4е- = 2Н2О, φ = 1,229 В (рН = 0) (15).
Коррозию, сопровождающуюся восстановлением (ионизацией) молекул кислорода (14), (15), называют коррозией с поглощением кислорода или коррозией с кислородной деполяризацией. С кислородной деполяризацией протекают следующие виды электрохимической коррозии: атмосферная, подземная, в пресной и морской воде, в растворах солей, в аэрированных растворах органических кислот.
Коррозию, сопровождающуюся восстановлением молекул воды и ионов водорода (12), (13), называют коррозией с выделением водорода или коррозией с водородной деполяризацией.
Металлы термодинамически нестабильные имеют значения стандартных электродных потенциалов больше, чем металлы группы повышенной термодинамической нестабильности, но не выше нуля. К этой группе относятся металлы: Cd, In, Tl, Co, Ni, Mo, Pb, W. Эти металлы не окисляются водой при рН = 7, но окисляются в кислых средах и в любых средах в присутствии кислорода.
Группа металлов промежуточной термодинамической стабильности: Bi, Sb, Re, Tc, Cu, Ag, Rh. Данные металлы имеют положительные значения стандартных электродных потенциалов, но не превышающие значения электродного потенциала, связанного с окисляющим действием кислорода в нейтральной среде (14). Эти металлы будут устойчивы в любых кислых и нейтральных средах в отсутствие кислорода.
Металлы высокой стабильности устойчивы во влажной атмосфере, то есть в присутствии кислорода в нейтральной среде. К данным металлам относятся Hg, Pd, Ir, Pt. Стандартные электродные потенциалы этих металлов находятся в интервале между значениями двух электродных потенциалов, характеризующих окисляющее действие кислорода в нейтральной и кислой средах, то есть от 0,816 В до 1,229 В.
Металлом полной стабильности является золото. Оно не может окисляться рассмотренными выше окислителями и у него максимальный электродный потенциал.
Чтобы получить уравнения реакций, лежащих в основе электрохимической коррозии металлов в различных средах, которые называются коррозионные токообразующие реакции, суммируют (10) поочередно с (12) – (15). Если уравнять число отданных и принятых электронов, то получим следующие уравнения
4M + nO2 + 2nH2O → 4M(OH)n (16)
4M + nO2 + 4nH+ → 4Mn+ + 2nH2O (17)
2M + 2nH2O → 2M(OH)n + nH2↑ (18)
2M + 2 nH+ → 2Mn+ + nH2↑ (19).
Причинами возникновения электрохимической коррозии служат различные виды неоднородностей как самой поверхности металла или сплава, так и коррозионной среды. В результате вся поверхность, соприкасающаяся с токопроводящей коррозионной средой, разделяется на катодные и анодные участки, которые имеют очень маленькие размеры и чередуются друг с другом. В такой среде они представляют собой совокупность огромного числа короткозамкнутых коррозионных гальванических микроэлементов. Коррозия осуществляется в результате протекания анодного процесса или коррозионного окисления металла и катодного процесса или восстановления окислителя, находящегося во влажной среде.
Рассмотрим различные случаи возникновения коррозионных гальванических пар.
1. Контакт с электролитом двух разных металлов в случае сочетания в одном узле или детали металлов различной активности в данной среде, или в случае применения сплава эвтектического типа из двух металлов разной активности,
2. Контакт металла и его соединения, обладающего металлообразными или полупроводниковыми свойствами. В любом случае свободный металл имеет отрицательный электрический заряд, а соединение — положительный заряд, так как в нем часть электронов проводимости связана. Этотакже справедливо и для интерметаллидов.
3. Различные концентрации электролитов или воздуха, растворенного в жидком электролите.
4. Различный уровень механических напряжений в одной и той же детали.
Механизм электрохимической коррозии, определяемый разностью потенциалов пассивных (катодных) и активных (анодных) участков, сводится к работе гальванического элемента, однако результат коррозионных разрушений может быть различен.
На механизм низкотемпературной коррозии влияет много различных причин: переменная температура и влажность воздуха, переменный состав газовой и электролитной среды и даже бактериальная флора, например при почвенной коррозии, так как некоторые виды бактерий способствуют окислению железа. Развитие коррозии в результате контакта разных металлов можно иллюстрировать схемой, представленной на рис. 1. Наибольшее коррозионное разрушение наблюдается рядом с контактом, так как здесь сопротивление наименьшее и, следовательно, наибольшая плотность тока.
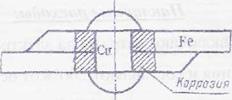
Рис. 1. Разрушение в месте контакта разных металлов
Если возникновение разности потенциалов вызвано применением эвтектических сплавов, состоящих из металлов различной активности, то не всегда можно руководствоваться данными по стандартным потенциалам растворения, так как активность изменяется в зависимости от состава электролита и рН среды.
Так, например, стандартный потенциал алюминия меньше стандартного потенциала цинка, а в растворе поваренной соли получается наоборот — εА1 > εZn и в данной паре цинк будет анодом. При контакте эвтектического сплава с электролитом может быть два случая:
1) коррозия сведется к вытравливанию из поверхностного слоя одного из компонентов (селективная коррозия);
2) коррозия может перейти в интеркристаллитную, если наиболее активный элемент входит только в состав эвтектики, разделяющей кристаллические зерна металлов. В сплавах металлов А и В, обладающих разной активностью (Sa<Sb), сплав состава 1—1 будет подвергаться селективной коррозии, а сплав состава 2—2 — интеркристаллитной, потому что активный металл А весь входит в состав.
Ввиду малой поверхности зерен А в эвтектике плотность тока будет большая и разрушение эвтектики пойдет в глубину. Поэтому рекомендуется в коррозионных средах применять только сплавы типа твердого раствора (JI-61, IX18H10).
Различные концентрации электролита могут вызвать коррозию, создавая гальваническую пару даже с одинаковыми металлами. Различное содержание кислорода также приводит к образованию гальванической пары — менее окисленный и более окисленный металл. Примером может служить коррозия металла под каплей воды (точечная коррозия, переходящая в питтинг): схема этого процесса приведена на рис. 2. Поверхностные слои воды содержат больше кислорода, чем внутренние, и поэтому средняя часть смоченного металла оказывается более активной (анод), чем внешняя (катод). После высыхания капли в ее центре появляется довольно глубокое пятно ржавчины. Если взять достаточно тонкую (0,2—0,1 мм) пластинку, например, стали, то можно получить сквозное отверстие. Такие процессы часто наблюдаются при атмосферной и почвенной коррозии.
Коррозионные пары могут возникать при действии внешних или внутренних механических напряжений. Такая коррозия встречается при сварке и происходит под действием остаточных напряжений. Если пластинку стали, дюраля или титанового сплава согнуть и в напряженном состоянии погрузить в коррозионную среду, то на растянутом слое (внешнем) через относительно короткое время возникнут трещины, а внутренний сжатый слой будет оставаться без изменений. Растягивающие усилия особенно опасны, так как в этом случае металл повышает свою активность.
Если согнутую упруго пластинку термически обработать и упругие деформации перейдут в пластические, то разности потенциалов нe возникает. Таким образом, при изготовлении деталей и узлов машин для снятия остаточных напряжений всегда следует термически обрабатывать изделия, если эти изделия предназначены для работы в сильно коррозионных средах.
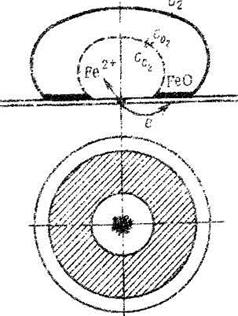
Рис. 2. Коррозия стали под неподвижной каплей воды
Эксплуатация деталей и узлов машин в коррозионной среде под действием наложенной разности потенциалов встречается редко. Обычно такой вид коррозии имеет место в случае случайного возникновения разности потенциалов за счет нарушения изоляции и утечки тока из соседних электрических линий. Эти случайно наложенные разности потенциалов могут приводить к опасным коррозионным разрушениям. Очень часто возникновение падения в почвах создается за счет электрического рельсового транспорта.
Рассмотрим коррозионное разрушение закладных металлических конструкций (трубы, детали фундаментов, кабель) под действием утечки тока, например, с трамвайного рельсового пути, который заглублен в грунт и может иметь высокое электрическое сопротивление за счет стыков рельс, которые плохо проводят электрический ток. Такой вид коррозии называется коррозия за счет блуждающих токов. В этом случае при хорошо проводящей влажной почве возможно разветвление тока, причем часть его пойдет через почву кратчайшим путем.
На пути так называемого «блуждающего» тока может находиться металлическое сооружение — плохо изолированная труба. Примем условно, что электролит, пропитывающий почву, содержит ионыС1-, Fe3+ и Na+. Электроны, выходящие из металла (рельса), по электролиту перемещаться не могут и в месте выхода их из рельса разряжают ионы Н+ или Fe3+. Ионы хлора будут перемещаться по почве, подходить к трубе и, разряжаясь, переводить металл в раствор. На выходе электронов из металла (трубы) не будет коррозии, тогда как на входе в рельс ионы хлора будут вызывать коррозию. Аналогичные явления могут наблюдаться и при переменном токе, но они менее опасны.
Тщательное соблюдение требований к электрической изоляции (битум, полиэтилен) закладных изделий и правильной эксплуатации электрических сетей может исключить электрокоррозию.
Дата добавления: 2017-02-13; просмотров: 3464;











