Электронные конфигурации атомов элементов Периодической системы.
Распределение электронов по различным АО называют электронной конфигурацией атома. Электронная конфигурация с наименьшей энергией соответствует основному состоянию атома, остальные конфигурации относятся к возбужденным состояниям.
Электронную конфигурацию атома изображают двумя способами – в виде электронных формул и электронографических диаграмм. При написании электронных формул используют главное и орбитальное квантовые числа. Подуровень обозначают с помощью главного квантового числа (цифрой) и орбитального квантового числа (соответствующей буквой). Число электронов на подуровне характеризует верхний индекс. Например, для основного состояния атома водорода электронная формула: 1s 1.
Более полно строение электронных уровней можно описать с помощью электронографических диаграмм, где распределение по подуровням представляют в виде квантовых ячеек. Орбиталь в этом случае принято условно изображать квадратом, около которого проставлено обозначение подуровня. Подуровни на каждом уровне должны быть немного смещены по высоте, так как их энергия несколько различается. Электроны изображаются стрелками ↑ или ↓ в зависимости от знака спинового квантового числа. Электронографическая диаграмма атома водорода:
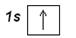
Принцип построения электронных конфигураций многоэлектронных атомов состоит в добавлении протонов и электронов к атому водорода. Распределение электронов по энергетическим уровням и подуровням подчиняются рассмотренным ранее правилам: принципу наименьшей энергии, принципу Паули и правилу Хунда.
С учетом структуры электронных конфигураций атомов все известные элементы в соответствии со значением орбитального квантового числа последнего заполняемого подуровня можно разбить на четыре группы: s-элементы, p-элементы, d-элементы, f-элементы.
В атоме гелия Не (Z=2) второй электрон занимает 1s-орбиталь, его электронная формула: 1s 2. Электронографическая диаграмма:
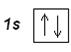
Гелием заканчивается первый самый короткий период Периодической системы элементов. Электронную конфигурацию гелия обозначают [He].
Второй период открывает литий Li (Z=3), его электронная формула:  Электронографическая диаграмма:
Электронографическая диаграмма:

Далее приведены упрощенные электронографические диаграммы атомов элементов, орбитали одного энергетического уровня которых расположены на одной высоте. Внутренние, полностью заполненные подуровни, не показаны.
После лития следует бериллий Ве (Z=4), в котором дополнительный электрон заселяет 2s-орбиталь. Электронная формула Ве: [He] 2s 2

В основном состоянии следующий электрон бора В (z=5) занимает 2р-орбиталь, В:1s22s22p1; его электронографическая диаграмма:

Следующие пять элементов имеют электронные конфигурации:
С (Z=6): [He] 2s 22p 2 N (Z=7): [He] 2s 22p 3

O (Z=8): [He] 2s 22p 4 F (Z=9): [He] 2s 22p 5
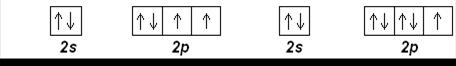
Ne (Z=10): [He] 2s 22p 6

Приведенные электронные конфигурации определяются правилом Хунда.
Первый и второй энергетические уровни неона полностью заполнены. Обозначим его электронную конфигурацию [Ne] и будем использовать в дальнейшем для краткости записи электронных формул атомов элементов.
Натрий Na (Z=11) и Mg (Z=12) открывают третий период. Внешние электроны занимают 3s-орбиталь:
Na (Z=11): [Ne] 3s 1
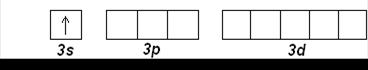
Mg (Z=12): [Ne] 3s 2
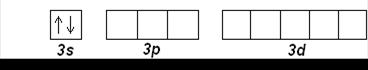
Затем, начиная с алюминия (Z=13), заполняется 3р-подуровень. Третий период заканчивается аргоном Ar (Z=18):
Al (Z=13): [Ne] 3s 23p 1


Ar (Z=18): [Ne] 3s 23p 6
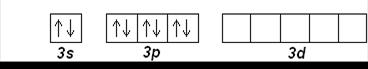
Элементы третьего периода отличаются от элементов второго тем, что у них имеются свободные 3d-орбитали, которые могут участвовать в образовании химической связи. Это объясняет проявляемые элементами валентные состояния.
В четвертом периоде, в соответствии с правилом (n+l), у калия К (Z=19) и кальция Са (Z=20) электроны занимают 4s-подуровень, а не 3d.Начиная со скандия Sc (Z=21) и кончая цинком Zn (Z=30), происходит заполнение3d-подуровня:
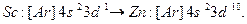
Электронные формулы d-элементов можно представить в ионном виде: подуровни перечисляются в порядке возрастания главного квантового числа, а при постоянном n – в порядке увеличения орбитального квантового числа. Например, для Zn такая запись будет выглядеть так: 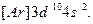 Обе эти записи эквивалентны, но приведенная ранее формула цинка правильно отражает порядок заполнения подуровней.
Обе эти записи эквивалентны, но приведенная ранее формула цинка правильно отражает порядок заполнения подуровней.
В ряду 3d-элементов у хрома Сr (Z=24) наблюдается отклонение от правила (n+l). В соответствии с этим правилом конфигурация Сr должна выглядеть так: 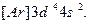 Установлено, что его реальная конфигурация -
Установлено, что его реальная конфигурация -  Иногда этот эффект называют «провалом» электрона. Подобные эффекты объясняются повышенной устойчивостью наполовину (p 3, d 5, f 7) и полностью (p 6, d 10, f 14) заполненных подуровней.
Иногда этот эффект называют «провалом» электрона. Подобные эффекты объясняются повышенной устойчивостью наполовину (p 3, d 5, f 7) и полностью (p 6, d 10, f 14) заполненных подуровней.
Отклонения от правила (n+l) наблюдаются и у других элементов (табл. 6). Это связано с тем, что с увеличение главного квантового числа различия между энергиями подуровней уменьшаются.
Далее происходит заполнение 4p-подуровня (Ga - Kr). В четвертом периоде содержится всего 18 элементов. Аналогично происходит заполнение 5s-, 4d- и 5p- подуровней у 18-ти элементов пятого периода. Отметим, что энергия 5s- и 4d-подуровней очень близки, и электрон с 5s-подуровня может легко переходить на 4d-подуровень. На 5s-подуровне у Nb, Mo, Tc, Ru, Rh, Ag находится только один электрон. В основном состоянии 5s-подуровень Pd не заполнен. Наблюдается «провал» двух электронов.
В шестом периоде после заполнения 6s-подуровня у цезия Cs (Z=55) и бария Ba (Z=56) следующий электрон, согласно правилу (n+l), должен занять 4f-подуровень. Однако у лантана La (Z=57) электрон поступает на 5d-подуровень. Заполненный на половину (4f7) 4f-подуровень обладает повышенной устойчивостью, поэтому у гадолиния Gd (Z=64), следующего за европием Eu (Z=63), на 4f-подуровне сохраняется прежнее количество электронов (7), а новый электрон поступает на 5d-подуровень, нарушая правило (n+l). У тербия Tb (Z=65) очередной электрон занимает 4f-подуровень и происходит переход электрона с 5d-подуровня (конфигурация 4f96s2). Заполнение 4f-подуровня заканчивается у иттербия Yb (Z=70). Следующий электрон атома лютеция Lu занимает 5d-подуровень. Его электронная конфигурация отличается от конфигурации атома лантана только полностью заполненным 4f-подуровнем.
Таблица 6
Исключения из (n+l) – правила для первых 86 элементов
| Элемент | Электронная конфигурация | |
| по правилу (n+l) | фактическая | |
| Cr (Z=24) Cu (Z=29) Nb (Z=41) Mo (Z=42) Tc (Z=43) Ru (Z=44) Rh (Z=45) Pd (Z=46) Ag (Z=47) La (Z=57) Ce (Z=58) Gd (Z=64) Ir (Z=77) Pt (Z=78) Au (Z=79) | [Ar] 4s 23d 4 [Ar] 4s 23d 9 [Kr] 5s 24d 3 [Kr] 5s 24d 4 [Kr] 5s 24d 5 [Kr] 5s 24d 6 [Kr] 5s 24d 7 [Kr] 5s 24d 8 [Kr] 5s 24d 9 [Xe] 6s 24f 15d 0 [Xe] 6s 24f 25d 0 [Xe] 6s 24f 85d 0 [Xe] 6s 24f 145d 7 [Xe] 6s 24f 145d 8 [Xe]6s 24f 145d 9 | 4s 13d 5 4s 13d 10 5s 14d 4 5s 14d 5 5s 14d 6 5s 14d 7 5s 14d 8 5s 04d 10 5s 14d 10 6s 24f 05d 1 6s 24f 15d 1 6s 24f 75d 1 6s 04f 145d 9 6s 14f 145d 9 6s14f145d10 |
В настоящее время в Периодической системе элементов Д.И. Менделеева под скандием Sc и иттрием Y располагаются иногда лютеций (а не лантан) как первый d-элемент, а все 14 элементов перед ним, включая лантан, вынося в особую группу лантаноидов за пределы Периодической системы элементов.
Химические свойства элементов определяются, главным образом, структурой внешних электронных уровней. Изменение числа электронов на третьем снаружи 4f-подуровне слабо отражается на химических свойствах элементов. Поэтому все 4f-элементы схожи по своим свойствам. Затем в шестом периоде происходит заполнение 5d-подуровня (Hf – Hg) и 6p-подуровня (Tl – Rn).
В седьмом периоде 7s-подуровень заполняется у франция Fr (Z=87) и радия Ra (Z=88). У актиния наблюдается отклонение от правила (n+l), и очередной электрон заселяет 6d-подуровень, а не 5f. Далее следует группа элементов (Th – No) с заполняющимся 5f-подуровнем, которые образуют семейство актиноидов. Отметим, что 6d- и 5f- подуровни имеют столь близкие энергии, что электронная конфигурация атомов актиноидов часто не подчиняется правилу (n+l). Но в данном случае значение точной конфигурации 5f т5d m не столь важно, поскольку она довольно слабо влияет на химические свойства элемента.
У лоуренсия Lr (Z=103) новый электрон поступает на 6d-подуровень. Этот элемент иногда помещают в Периодической системе под лютецием. Седьмой период не завершен. Элементы 104 – 109 неустойчивы и их свойства малоизвестны. Таким образом, с ростом заряда ядра периодически повторяются сходные электронные структуры внешних уровней. В связи с этим следует ожидать и периодического изменения различных свойств элементов.
Отметим, что описанные электронные конфигурации относятся к изолированным атомам в газовой фазе. Конфигурация атома элемента может быть совершенно иной, если атом находится в твердом теле или растворе.
Дата добавления: 2017-02-13; просмотров: 3977;











