Общие представления о химической связи.
Учение о химической связи является центральным разделом современной химии. Химическая связь определяется природой взаимодействия атомов в веществе (газах, жидкостях, твердых телах). Атомы всех элементов могут соединяться друг с другом с образованием устойчивых частиц. Химически связанные атомы образуют молекулу, кристалл и даже более сложное соединение. Химическая связь образуется в результате взаимодействия друг с другом ядер, электронов, а также ядер и электронов. Взаимодействие возникает при сближении атомов и имеет электрическую природу.
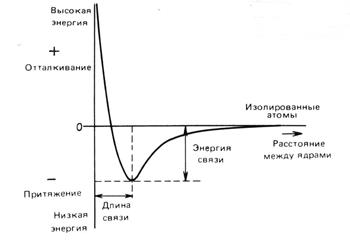
Рис. 1. Изменение энергии взаимодействия атомов в зависимости от межъядерного расстояния.
Наиболее общие признаки химической связи на примере молекулы, образованной из двух атомов, представлены на рис. 1. К двухатомным молекулам относятся такие, как H2, N2. Факторами, определяющими образование химической связи, являются межъядерное расстояние и энергия взаимодействия атомов. На рис. 1 показано изменение энергии взаимодействия двух атомов, которое происходит в результате их сближения. На больших расстояниях друг от друга энергия взаимодействия атомов близка к нулю. При сближении атомов между ними возникает слабое, по сравнению с другими силами, Ван-дер-Ваальсово взаимодействие, которое обуславливает притяжение и увеличение энергии связи. Когда межъядерное расстояние становится соизмеримым с размерами электронных оболочек атомов, появляется наряду с притяжение еще и отталкивание. При таких расстояниях между атомами имеют место два конкурирующих взаимодействия: притяжение и отталкивание. Притяжение возникает между положительно заряженными ядрами одного и отрицательно заряженными электронами другого атома. Одновременно с этим возникает отталкивание между одноименно заряженными ядрами и электронами обоих атомов. В начале при сближении атомов преобладает притяжение, но с некоторого расстояния энергия отталкивания резко возрастает. Этому расстоянию соответствует минимум на кривой. Данное расстояние характеризует устойчивость рассматриваемой системы двух атомов и соответствует образованию стабильной молекулы. Подобная стабильность обеспечивается равенством сил притяжения и отталкивания. Таким образом, химическая связь между атомами в двухатомной молекуле характеризуется равновесным межъядерным расстоянием или длиной связи и энергией связи (энергией диссоциации). Приведенная картина имеет лишь качественный характер. Она не объясняет существование разных типов связей. Более точное и строгое рассмотрение природы химической связи требует привлечения законов, описывающих поведение электронов и атомов на микроскопическом уровне.
Многочисленные исследования показывают, что знание природы химических связей позволяет понять причины многообразия химических соединений, механизм их образования, состав, строение, реакционную способность и некоторые другие свойства.
Но определение микроскопической природы химической связи является очень сложной задачей. Современные методы исследования дают возможность экспериментально определить лишь пространственное расположение в веществе атомных ядер. Так как масса ядра во много раз больше массы электрона, то заданному пространственному размещению атомных ядер отвечает определенное распределение электронной плотности. Поэтому, для более точного описания химической связи в веществе, необходимо определить, как распространяется электронная плотность в пространстве относительно ядер. В настоящее время для этого используют теоретические методы, заключающиеся в решении уравнения Шредингера в том или ином приближении. Сложность задачи заключается в том, что данное уравнение невозможно решить точно, даже в самом простом случае – молекулы из двух атомов (пример, молекула водорода H2). Поэтому применяются приближенные методы. Наиболее точное решение уравнения Шредингера осуществлено для иона H2+ , состоящего из двух протонов и одного электрона. Тем не менее, и приближенные методы дают удовлетворительные результаты, согласующиеся с известными экспериментальными данными.

Рис. 2. Карты электронной плотности.
Результат приближенного расчета распределения электронной плотности в молекуле воды показан на рис. 2. Контурные линии соединяют места одинаковой электронной плотности. Числами указаны значения электронной плотности.
Дата добавления: 2017-02-13; просмотров: 1803;











