Строение атома. Квантово-механическая модель атома.
До конца 19 века атом считался неделимым. Затем по мере накопления опытных данных пришлось отказаться от таких взглядов и признать, что атомы имеют сложное строение.
Для объяснения опытных данных по рассеянию 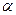 - частиц Э. Резерфорд предложил ядерную модель атома. Согласно этой модели атом состоит из массивного положительно заряженного ядра, при этом очень малого по размерам. В ядре сосредоточена почти вся масса атома. Вокруг ядра на значительном расстоянии от него вращаются электроны, образующие электронную оболочку атома.
- частиц Э. Резерфорд предложил ядерную модель атома. Согласно этой модели атом состоит из массивного положительно заряженного ядра, при этом очень малого по размерам. В ядре сосредоточена почти вся масса атома. Вокруг ядра на значительном расстоянии от него вращаются электроны, образующие электронную оболочку атома.
Размер всего атома составляет около 10-8 см, ядра – порядка 10-13 см. По размеру ядро примерно в 100000 раз меньше атома.
Поскольку атом в целом электронейтрален, то суммарный заряд электронов должен быть равен заряду ядра. Дальнейшие исследования показали, что положительный заряд ядра атома численно равен порядковому номеру элемента в периодической системе Д.И. Менделеева.
Таким образом, число положительных зарядов ядра каждого атома, а также число вращающихся в поле ядра электронов равны порядковому номеру элемента.
Порядковый номер атома титана равен 22. Значит, его положительный заряд равен 22 и в поле ядра вращаются 22 электрона.
При химических реакциях ядро атома не претерпевает изменений. Изменению подвергаются электронные оболочки атомов, строением которых объясняются многие свойства химических элементов. Поэтому состояние электронов в атоме определяет многие свойства.
Электрон – это очень маленькая частица, для которой законы классической механики не выполняются. Такая частица не имеет траектории, обладает волновыми свойствами. Для её характеристики требуется привлечение других понятий. Состояние электронов в атоме описывается квантовой механикой.
Квантовая механика базируется на трех основных положениях:
энергетические изменения, происходящие в микросистемах, носят дискретный характер (принцип квантования энергии);
поведение микрочастиц (в том числе и электронов) определяется двойственностью их природы (корпускулярно-волновой дуализм);
законы микромира обусловлены статистическим (вероятностным) характером.
Квантование энергии. Для объяснения способностей излучения нагретых тел М. Планк в 1900 г. выдвинул предположение, что энергия излучается и поглощается не непрерывно, а дискретно отдельными порциями – квантами. Энергия Е кванта зависит от частоты электромагнитного излучения ν:
Е=hν (1),
где h – постоянная Планка; ν=с/λ (λ – длина волны излучения); с – скорость света. Идея о квантовании энергии позволила объяснить фотоэлектрический эффект (А.Эйнштейн,1905) и линейчатую структуру атомных спектров (Н. Бор,1913).
Корпускулярно-волновой дуализм характеризует способность любого объекта проявлять одновременно волновые и материальные свойства. Двойственная природа микромира была впервые установлена для излучения. С одной стороны, для излучения характерны такие явления, как интерференция и дифракция, которые характеризуют его волновую природу. С другой стороны, излучение проявляет свойства частиц, о чем свидетельствует явление фотоэффекта. Эйнштейн предположил, что излучение испускается в виде частиц, называемых фотонами или квантами. Каждый фотон обладает энергией, определяемой (1).
В силу корпускулярной природы излучения фотоны должны обладать определенной массой. Масса покоя фотона равна нулю, а при движении фотон приобретает динамическую массу. Для вычисления этой массы Эйнштейн обосновал применение уравнение эквивалентности массы и энергии:
Е=mc2.
В то же время Е=hν=h(с/λ). Отсюда следует
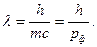 (2).
(2).
Здесь рф=mc – импульс фотона. Французский физик Л. де Бройль в 1923 г. предположил, что двойственной природой обладает не только свет, но и любой материальный объект (в частности, электрон). Длина волны любого движущегося объекта
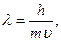 (3),
(3),
где m – масса частицы; 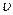 - скорость движения частицы; λ – длина волны объекта, называемая длиной волны де Бройля. Из этого выражения следует, что чем меньше масса частицы, тем больше длина ее волны и тем значительней проявляются ее волновые свойства.
- скорость движения частицы; λ – длина волны объекта, называемая длиной волны де Бройля. Из этого выражения следует, что чем меньше масса частицы, тем больше длина ее волны и тем значительней проявляются ее волновые свойства.
Уравнение де Бройля (3) в 1927 г. было подтверждено экспериментально. Американские физики Дж. Дэвиссон и А. Джермер обнаружили дифракцию электронов на монокристаллах никеля Ni. Позднее способность к дифракции была обнаружена у других микрообъемов (атомов гелия Не, молекул водорода Н2, нейтронов).
В макромире волновые свойства не проявляются – перемещение тел хорошо описывается как движение частиц. Причина заключается в том, что постоянная Планка очень мала, поэтому длины волн оказываются соизмеримыми с размерами частиц только в микромире.
Принцип неопределенности. Волновые свойства микрочастиц выражаются также в ограниченности применения к ним некоторых понятий классической механики, а именно координаты и импульса. Например, один из способов наблюдения за объектом – воздействие на него электромагнитного излучения (свет, радиоволны) и регистрация отраженного сигнала, что широко используется в радиолокации, эхолокации. Причем чем сильнее воздействие на наблюдаемый объект, тем сильнее отраженный сигнал. Если ведется наблюдение за микрообъектами, то действие на них электромагнитного излучения не изменяет ни их положения, ни их скорости. В случае наблюдения за объектами микромира (например, электронами) ситуация выглядит иначе. При действии кванта света (фотона) на микрочастицу ее скорость не остается без изменения. Зная положение микрочастицы в какой-то момент времени, нельзя в это же мгновение определить ее скорость, поскольку она уже изменилась.
В. Гейзенберг в 1927 г. предложил соотношения, которые получили название принципа неопределенности. Согласно этому принципу, невозможно одновременно точно определить координаты частица и ее импульс.
Математически принцип неопределенности формулируется следующим образом:
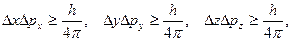
где Δx, Δy, Δz – погрешность определения координат x, y, z соответственно; Δpx, Δpy, Δpz – погрешность определения проекций импульса на оси координат. Из этих соотношений следует, что чем точнее определены координаты электрона, тем с меньшей точностью будет найден его импульс, и наоборот. Другими словами, говорить о траектории движения электрона не имеет смысла, так как для ее описания необходимо точно знать координаты электрона и его импульс в каждый момент времени. Из соотношений неопределенности следует, что точно описать движение такой микрочастицы, как электрон невозможно. Движение электрона можно описать, используя вероятностный подход, причем есть лишь определенная вероятность нахождения электрона в заданной области пространства.
Движущейся частице можно поставить в соответствие волновой процесс с длиной волны (3), тогда этот процесс будет характеризоваться частотой ν и волновой функцией Ψ – величиной, определяющей волнообразно распространяющееся возмущение.

Здесь ψ(x, y, z) – амплитуда волн де Бройля или координатная волновая функция, зависящая только от пространственных координат.
Стационарное уравнение Шрёдингера.
Законы движения частиц в квантовой механике выражаютсяуравнением Шрёдингера, которое играет ту же роль, что и законы Ньютона в классической механике. Уравнение Шрёдингера представляет собой дифференциальное уравнение в частных производных. Э. Шрёдингер в 1926 г. предложил использовать волновое уравнение в качестве модели для описания поведения электрона в атоме – уравнение, связывающее энергию системы с ее волновым движением. Стационарное уравнение Шрёдингера для одной части можно записать в следующей форме:
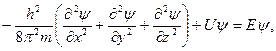 (4)
(4)
где U – потенциальная энергия частицы; Е – ее полная энергия; x, y, z – декартовы координаты. Входящую в (4) переменную величину называют ψ волновой функцией. Эта функция описывает все свойства системы в стационарном состоянии – состоянии, которое не изменяется во времени. Функция ψ зависит от координат частиц и может зависеть от времени. Квадрат ее абсолютной величины |ψ|2 характеризует вероятность нахождения частицы в данном месте пространства. Величина |ψ|2dV равна вероятности нахождения рассматриваемой частицы в элементе объема dV=dxdydz.
Уравнение Шрёдингера часто записывают в следующей форме:

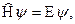 (5)
(5)
где 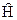 - оператор Гамильтона:
- оператор Гамильтона:
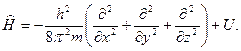 (6)
(6)
Квантово-механическое решение задач в теории атома и молекулы сводится к нахождению удовлетворяющих уравнению Шрёдингера волновых функций и значений энергии. Вообще говоря, может быть несколько различных функций ψ1, ψ2, ψ3, …, ψn, которые являются решениями уравнения Шрёдингера, причем каждой соответствует свое значение энергии E1, E2, …, En.
Волновые функции, для которых уравнение Шрёдингера имеет решение, называют собственными функциями; значения энергии, вычисленные из таких решений – собственными значениями.
Таким образом, согласно представлениям квантовой механики, вероятность пребывания электрона в различных областях пространства неодинакова. Современным представлениям отвечает понятие об электронном облаке, плотность которого в различных точках определяется |ψ|2. В научной литературе используют понятие «орбиталь», которое характеризует совокупность положений электрона в атоме. Каждой орбитали соответствует определенная волновая функция.
Уравнение (6) в сферических координатах приобретает вид
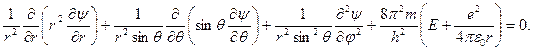
Решая это уравнение, получают
 (7)
(7)
где R(r) – радикальная составляющая волновой функции; Θ(θ) и Φ(φ) – угловые составляющие волновой функции. Следовательно, волновые функции в (7) зависят от трех целочисленных параметров n, l и m, которые называют квантовыми числами.
Квантовые числа. Атомные орбитали.
Волновую функцию (7), описывающую состояние электрона, называют атомной орбиталью (АО).
Квантовые числа. В квантовой механике каждая АО определяется тремя квантовыми числами.
Главное квантовое число n. Может принимать целочисленные значения от 1 до ∞. Главное квантовое число определяет:
номер энергетического уровня;
интервал энергий электронов, находящихся на данном уровне;
размеры орбиталей;
число подуровней данного энергетического уровня (первый уровень состоит из одного подуровня, второй – из двух, третий – из трех и т.д.);
В Периодической системе элементов максимальному значению главного квантового числа соответствует номер периода.
Орбитальное квантовое число l.Определяет орбитальный момент количества движения (импульс) электрона, точное значение его энергии и форму орбиталей. Может принимать значения 0, 1, 2, 3, …, (n-1).
Атомная орбиталь – геометрический образ одноэлектронной волновой функции ψ, представляющий собой область наиболее вероятного пребывания электрона в атоме. Она ограничивает область пространства, в которой вероятность нахождения электрона имеет определенное значение (90 …99 %). Иногда орбиталью называют граничную поверхность этой области, а на рисунках, как правило, изображают сечение этой области плоскостью, проходящей через начало координат и лежащей в плоскости рисунка. В начало координат помещают центр ядра атома. Понятие «орбиталь», в отличие от «орбита», не подразумевает знания точных координат электрона. Орбитальное квантовое число определяет форму атомной орбитали. При l =0 это сфера, при l =1 – объемная восьмерка (гантель), при l=2 – четырехлепестковая розетка.
Каждому значению главного квантового числа соответствует n значений орбитального квантового числа l (табл. 1). Например, если n=1, то l принимает только одно значение (l =0), n =2 – два значения: 0 и 1 и т.д. Каждому численному значению l соответствует определенная геометрическая форма орбиталей и приписывается буквенное обозначение. Первые четыре буквы обозначения имеют историческое происхождение и связаны с характером спектральных линий. s, p, d, f – первые буквы английских слов, использованных для названия спектральных линий: sharp (резкий), principal (главный), diffuse (диффузный), fundamental (основной). Обозначения других орбиталей приведены в алфавитном порядке: g, h, …
Таблица 1
Значения главного и орбитального квантовых чисел
| Орбитальное квантовое число l | Главное квантовое число n | ||||||||||||||
| Значение Буквенное обозначение | s | s | p | s | p | d | s | p | d | f | s | p | d | f | g |
Обозначение любого подуровня определяется двумя квантовыми числами – главным (при записи указывается численное значение) и орбитальным (при записи указывается буквенное обозначениеорбитальным ()ается численное значение двумя квантовыми числами - главным ). Например, энергетический подуровень, для которого n =2 и l =1, следует обозначить так: 2р-подуровень. Все орбитали с одинаковым значением l имеют одинаковую геометрическую формулу и в зависимости от значений главного квантового числа различаются размерами. Например, все орбитали, для которых l =0 (s-орбитали) являются сферически симметричными, различаются размерами в зависимости от значения главного квантового числа. Чем выше значение n, тем больше размеры орбиталей.
Магнитное квантовое число ml.Определяет возможные значения проекции орбитального момента количества движения электрона на фиксированное направление в пространстве (например, на ось z). Оно принимает отрицательные и положительные значения l, включая нуль. Общее число значений равно 2l+1:
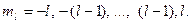
От значения магнитного квантового числа зависит взаимодействие магнитного поля, создаваемого электроном, с внешним магнитным полем. Если нет внешнего магнитного поля, то энергия электрона в атоме не зависит от ml. В этом случае электроны с одинаковыми значениями n и l, но с разными значениями ml обладают одинаковой энергией. Если существует внешнее магнитное поле – энергия электронов с разными ml различается.
В общем случае магнитное квантовое число характеризует ориентацию АО в пространстве относительно внешней силы. Магнитное квантовое число определяет ориентацию орбитального углового момента относительно некоторого фиксированного направления.
Общее число возможных значений ml соответствует числу способов расположения орбиталей данного подуровня в пространстве, то есть общему числу орбиталей на данном подуровне (табл. 2).
Таблица 2
Число орбиталей на подуровне
| Главное квантовое число n | Число значений ml | Квантовое число | |
| l | ml | ||
| 0 (s) 0 (s) 1 (p) 0 (s) 1 (p) 2 (d) | -1, 0, +1 -1, 0, +1 -2, -1, 0, +1, +2 |
Орбитальному квантовому числу l =0 отвечает единственное значение магнитного квантового числа ml =0. Эти значения l и ml характеризуют все s-орбитали, которые имеют форму сферы. Так как в этом случае магнитное квантовое число принимает только одно значение, то каждый s-подуровень состоит только из одной орбитали. Рассмотрим любой р-подуровень. При l =1 орбитали имеют форму гантелей (объемные восьмерки), магнитное квантовое число принимает следующие значения: ml = -1, 0, +1. Следовательно, р-подуровень состоит из трех АО, которые располагаются вдоль осей координат, их обозначают px, py, pz соответственно (рис. 1).
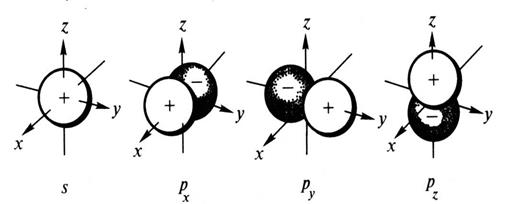
Рис. 1. Пространственная форма s- и р-атомных орбиталей.
Для d-подуровня l =2, ml = -2, -1, 0, +1, +2 (всего 5 значений), и любой d-подуровень состоит из пяти атомных орбиталей, которые определенным образом расположены в пространстве (рис. 2), и обозначаются 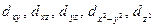 соответственно.
соответственно.
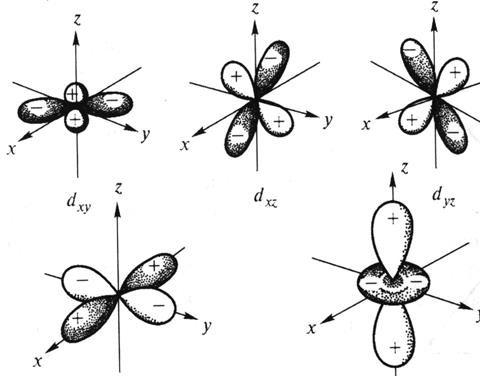
Рис. 2. Пространственная форма d-атомных орбиталей.
Четыре из пяти d-орбиталей имеют форму четырехлепестковых розеток, каждая из которых образована двумя гантелями, пятая АО представляет собой гантель с тором в экваториальной плоскости ( 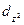 -орбиталь) и расположена вдоль оси z. Лепестки орбитали
-орбиталь) и расположена вдоль оси z. Лепестки орбитали  расположены вдоль осей x и y. Лепестки орбиталей
расположены вдоль осей x и y. Лепестки орбиталей  расположены симметрично между соответствующими осями.
расположены симметрично между соответствующими осями.
Четвертый энергетический уровень состоит из четырех подуровней – s, p, d и f. Первые три из них аналогичны описанным выше, а четвертый f-подуровень состоит из семи АО, пространственная форма которых достаточно сложна и в данном разделе не рассматривается.
С. Гаудсмит и Дж. Уленбек для описания некоторых тонких эффектов в спектре атома водорода в 1925 г. выдвинули гипотезу о наличии собственного момента импульса электрона, который назвали спином. Спин нельзя выразить через координаты и импульсы, у него нет аналога в классической механике. Спиновое число s электрона принимает только одно значение, равное 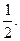 Проекция вектора спина на определенное направление внешнего поля (например, на ось z) определяется спиновым квантовым числом mS, которое может принимать два значения: mS =
Проекция вектора спина на определенное направление внешнего поля (например, на ось z) определяется спиновым квантовым числом mS, которое может принимать два значения: mS = 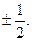
Понятие «спин» введено для характеристики специфического квантового свойства электрона. Спин – это проявление релятивистских эффектов на микроскопическом уровне.
Электрон имеет четыре степени свободы. Спиновое квантовое число принимает только дискретные значения: 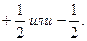 Таким образом, состояние электрона в атоме определяется набором значений четырех квантовых чисел: n, l, ml, mS.
Таким образом, состояние электрона в атоме определяется набором значений четырех квантовых чисел: n, l, ml, mS.
Обозначение и структура электронных энергетических уровней. Определим некоторые термины, которые используются для разъяснения физического смысла квантовых чисел. Группа орбиталей, имеющих одинаковое значение орбитального квантового числа, образует энергетический подуровень. Совокупность всех орбиталей с одинаковым значением главного квантового числа образует энергетический уровень.
Структуру атомных электронных уровней можно изобразить двояко: в виде электронных формул и электронографических диаграмм. При написании электронных формул используют два квантовых числа n и l: первый уровень – 1s; второй – 2s, 2p; третий – 3s, 3p, 3d; четвертый – 4s, 4p, 4d, 4f и т.д. (табл.3).
Таблица 3
Структура электронных энергетических уровней атома
| Главное квантовое число n | Обозначение подуровня | Квантовое число | |
| l | ml | ||
| 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f | -1, 0, +1 -1, 0, +1 -2, -1, 0, +1, +2 -1, 0, +1 -2, -1, 0, +1, +2 -3, -2, -1, 0, +1, +2, +3 |
Более полно строение электронных уровней описывается с использованием трех квантовых чисел: n, l, ml . Каждая АО условно изображается в виде квантовых ячеек, около которой ставится номер уровня и символ подуровня.
Дата добавления: 2017-02-13; просмотров: 2703;











