ЗАКОНИ ІДЕАЛЬНИХ ГАЗІВ.
Висловлює зв'язок між параметрами рівноважного стану термодинамічної системи, який в загальному випадку можна описати виразом:
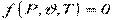 ,
,
тобто визначається завданням двох параметрів стану, наприклад, тиску 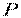 і питомого об'єму
і питомого об'єму 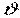 (температура
(температура 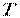 в цьому випадку є функцією
в цьому випадку є функцією 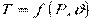
У технічній термодинаміці в якості робочого тіла розглядається ідеальний газ - теоретична модель реального газу, в якій не враховується взаємодія часток газу, молекул, що являють собою безоб'ємні матеріальні точки; силами міжмолекулярного зчеплення зневажають. Це дає підставу кожен дійсно існуючий у природі газ, в якому можна знехтувати силами зчеплення та об'ємом молекул (через малу їх величину), називати ідеальним газом. Ця обставина тим більш справедлива, чим вище температура газу і менше тиск.
Предметом даної лекції є рівноважні ізотермічні, адіабатні, ізохорні, ізобарні процеси ідеальних газів. З певною мірою наближення можна вважати, що реальні процеси газів можуть бути саме такими. Через це вивчення їх важливе для практики.
Так, наприклад, можна вважати адіабатним процес розширення газу безпосередньо після хімічної реакції, що супроводжує вибух. Це обґрунтовує застосування рівнянь адіабатного процесу для розрахунку розміру панелей, що легко відкидаються під дією вибуху, запобігаючи руйнуванню будівлі.
Нагрівання газів та пари у закритих судинах можна вважати ізохорним процесом і використовувати його рівняння для визначення максимальних допустимих тиску та температури.
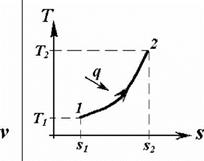
Ізохорний процес
Процес, у ході якого об’єм не змінюється, має назву ізохорного процесу. Таким чином, його визначення має вид формули V = const, що з урахуванням узагальненого газового закону дає відомий закон Шарля:
P /T = const, P1 /T1 = P2 /T2
Графіки ізохорного процесу представлено на рисунку 3.1.
|
|
| Рисунок 2.1 - Графік ізохорного процесу у P-v- та T-s-координатах |
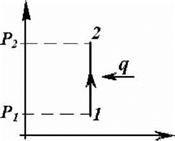
Ізобарний процес
Визначення ізобарного процесу – процес, що проходить за сталого тиску: P = const. З урахуванням узагальненого газового закону, рівняння ізобар-ного процесу приймає вид закону Гей-Люсака:
V /T = const, V1 /T1 = V2 /T2 .
P-V- та T-S-діаграми процесу зображено на рисунку 2.2.

| Рисунок 2.2 - P-V- та T-S-діаграми ізобарного процесу 1-2 (неперервна лінія) |
Дата добавления: 2021-06-28; просмотров: 567;











