ОСНОВНІ ПАРАМЕТРИ СТАНУ РОБОЧОГО ТІЛА
Термодинаміка –наука, що вивчає енергію та закони її перетворення з одних видів в інші. Розділяється на загальну, хімічну й технічну. Загальна (фізична) термодинаміка дає поняття про загальні теоретичні основи й закономірності перетворення енергії. Хімічна термодинаміка вивчає теплові ефекти хімічних реакцій і процесів.
Технічна термодинаміка, основа інженерної теплотехніки, – розділ термодинаміки, що займається застосуванням законів термодинаміки в теплотехніці. Головне її завдання – обґрунтування теорії теплових двигунів, енергетичних установок та теплотехнічного обладнання.
У термодинаміці використовується феноменологічний метод дослідження, при якому не вводяться ніякі припущення щодо молекулярної будови досліджуваних тіл. Тобто, вона виходить із загальних законів, що отримані експериментально.
Технічна термодинаміка ґрунтується на трьох основних законах (основах): першому, що являє собою застосування до теплових систем закону перетворення та збереження енергії, другому, який характеризує напрямок протікаючих у природі процесів та явищ, і третьому, стверджуючому, що абсолютний нуль температури недосяжний.
Отже, даній науці властивий високий рівень абстракції термодинамічної моделі об'єкта дослідження. Це робить термодинаміку і її методи придатними для вирішення багатьох практичних задач в різних галузях науки і техніки, але не дозволяє пояснити причини, природу явищ, що відбуваються. Термодинаміка як інструмент пізнання закономірностей матеріального світу одержало загальне визнання і довела велику користь від її використання.
Вся минула і сучасна її історія підтверджує слова великого фізика Альберта Ейнштейна: «Теорія справляє тим більше враження, чим простіші її передумови і обширніша область застосування. Термодинаміка – єдина фізична теорія універсального змісту, яка в межах прийнятих нею основних понять ніколи не буде спростована».
Тепловий рух – безладний (хаотичний) рух мікрочастинок (молекул, атомів та ін.), з яких складаються всі тіла.
Передача енергії в результаті обміну хаотичним, ненаправленим рухом мікрочастинок називається теплообміном, а кількість переданої при цьому енергії – кількістю теплоти, теплотою процесу або просто теплотою.
Вивчаючи поведінку речовин (об'єктів), що беруть участь у процесах з обміном енергією, термодинаміка виділяє їх із сукупності навколишніх тіл. Звідси випливає таке важливе поняття як термодинамічна система.
Термодинамічною системою називається сукупність макроскопічних тіл, що обмінюються енергією між собою і навколишнім середовищем (всіма іншими тілами, які не ввійшли в термодинамічну систему). Вона має межі, що відокремлюють її від навколишнього середовища, і можуть бути як реальними (газ у резервуарі, межа розділу фаз), так і чисто умовними у вигляді контрольної поверхні.
Термодинамічна система, між будь-якими частинами якої відсутні поверхні розділу, називається гомогенною. Якщо ж вона складається з окремих частин, розмежованих поверхнями розділу, – гетерогенною, однорідна частина якої називається фазою.
Термодинамічна система може енергетично взаємодіяти з навколишнім середовищем і з іншими системами, а також обмінюватися з ними речовиною.
Залежно від умов взаємодії з іншими системами розрізняють: відкриту систему – при наявності обміну енергією та речовиною з іншими; закриту – при відсутності обміну речовиною з іншими системами; адіабатну – при відсутності обміну теплотою з іншими системами; ізольовану – при відсутності обміну енергією й речовиною з іншими системами.
Розрізняють рівноважний і нерівноважний стани термодинамічної системи. Рівноважним термодинамічним станом називають стан тіла чи системи, що не змінюється в часі без зовнішнього енергетичного впливу. При цьому зникають усякі макроскопічні зміни (дифузія, теплообмін, хімічні реакції), хоча тепловий (мікроскопічний) рух молекул не припиняється. Стан термодинамічної системи, при якому у всіх її частинах температура однакова, називають ізотермічним рівноважним станом.
Ізольована термодинамічна система незалежно від свого початкового стану із часом завжди приходить у стан рівноваги, з якого ніколи не може вийти самовільно.
Стан термодинамічної системи, при якому значення параметрів у всіх її частинах лишаються незмінними в часі (через зовнішній вплив потоку речовини, енергії, імпульсу і т.д.), називається стаціонарним. Якщо значення параметрів змінюються в часі, то стан термодинамічної системи називається нестаціонарним.
Параметри стану – фізичні величини, що однозначно характеризують стан термодинамічної системи і не залежні від її передісторії.
Основні термодинамічні параметри стану системи, що характеризують макроскопічний стан тіл: тиск, температура і питомий об'єм ( 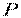 ,
, 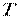 ,
, 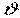 ).
).
Тиск – фізична величина, чисельно рівна нормальній складовій сили, що діє на одиницю площі поверхні тіла. Тиск може вимірюватися висотою стовпа рідини (у мм ртутного, водяного та ін.), що врівноважує тиск розглянутого середовища. При цьому 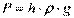 або
або 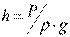 , Де
, Де 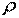 –густина рідини,
–густина рідини, 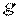 – прискорення вільного падіння.
– прискорення вільного падіння.
Для вимірювання тиску застосовують барометри, манометри і вакуумметри. Відповідно розрізняють атмосферний або барометричний тиск, абсолютний тиск, манометричний або надлишковий, розрідження або вакуум.
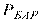 – барометричний тиск (атмосферний, заміряний барометром);
– барометричний тиск (атмосферний, заміряний барометром);
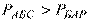 :
: 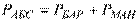 – абсолютний тиск з урахуванням надлишкового (манометричного) тиску;
– абсолютний тиск з урахуванням надлишкового (манометричного) тиску;
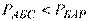 :
: 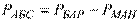 – абсолютний тиск у випадку розрідження (вакууму).
– абсолютний тиск у випадку розрідження (вакууму).
У термодинаміці параметром стану тіла є тільки абсолютний тиск, відлічений від нуля (абсолютного вакууму), що характеризує стан термодинамічної системи.
Атмосферний тиск – величина змінна, тому в техніці застосовується нормальний атмосферний тиск, 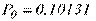 МПа (760 мм рт. ст.).
МПа (760 мм рт. ст.).
Тиск вимірюють в Паскалях: 1 Па рівний тиску 1 Н (сили, що надає тілу масою 1 кг прискорення 1 м/с 2 у напрямку дії сили) на площі 1 м 2, тобто 1 Па = 1 Н/м 2. Позасистемними одиницями тиску є атмосфера (1 ат = 1 кгс/см 2) і бар (1 бар = 10 5 Н/м 2 = = 1,01972 кгс/см 2 = 750,06 мм рт. ст. = 10197 мм вод. ст.; 1 ат = = 1 кг/см 2 = 735,6 мм рт. ст. = 10000 мм вод. ст. = 98066 Н/м 2, див. також табл. 3.1.
Молекулярно-кінетична теорія газу дозволяє встановити зв'язок між тиском і кінетичною енергією теплового руху молекул газу, пари або рідини. Тиск являє собою, відповідно до цієї теорії, статистично усереднену величину імпульсу, що переноситься в результаті хаотичного (теплового) руху молекул в одиницю часу через одиницю площі поверхні, яка обмежує об'єм системи
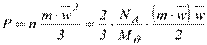 ,
,
де 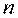 – число молекул в 1 м 3;
– число молекул в 1 м 3; 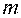 – маса молекули, кг;
– маса молекули, кг; 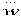 – середньоквадратична швидкість молекул, м/с;
– середньоквадратична швидкість молекул, м/с; 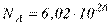 – число Авогадро;
– число Авогадро; 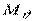 – молекулярний об'єм речовини газу, м 3 /кмоль; вираз
– молекулярний об'єм речовини газу, м 3 /кмоль; вираз 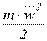 визначає середню кінетичну енергію поступального руху однієї молекули.
визначає середню кінетичну енергію поступального руху однієї молекули.
Молекулярно-кінетична теорія газів встановлює пряму пропорційність між середньою кінетичною енергією поступального руху молекул і абсолютною температурою:
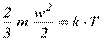 ,
,
де 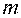 – маса молекули, кг;
– маса молекули, кг; 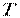 – абсолютна температура,
– абсолютна температура, 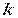 10×– постійна Больцмана, рівна 1,3806 -23 Дж/К.
10×– постійна Больцмана, рівна 1,3806 -23 Дж/К.
Отже, абсолютна температура є мірою середньої кінетичної енергії поступального руху молекули і відноситься до всієї сукупності молекул, що рухаються з різними швидкостями.
З виразів (3.1), (3.2) випливає рівняння
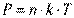 , (3.3)
, (3.3)
яке називають основним рівнянням кінетичної теорії газів. З рівняння (3.3) виходить: тиск 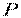 тим більше, чим вище абсолютна температура
тим більше, чим вище абсолютна температура 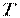 і чим більше молекул в одиниці об'єму; тиск має не тільки механічний, але і статистичний зміст, тому що він зв'язаний з температурою.
і чим більше молекул в одиниці об'єму; тиск має не тільки механічний, але і статистичний зміст, тому що він зв'язаний з температурою.
Температура. Абсолютна температура робочого тіла – міра інтенсивності теплового руху молекул (завжди позитивна, її нульове значення відповідає стану повного спокою молекул, точці початку відліку температури (нулю) термодинамічної шкали Кельвіна). У техніці прийнята шкала Цельсія (нуль якої 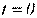 C відповідає температурі танення льоду при нормальному тиску, тобто при°
C відповідає температурі танення льоду при нормальному тиску, тобто при° 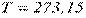 К).
К).
Температура характеризує величину нагрівання тіла і визначає напрямок передачі теплоти. Якщо два тіла А і В мають відповідно температуру 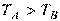 , то теплота переходить від тіла А до тіла В. При цьому температура тіла А зменшується, а температура тіла В збільшується. Якщо
, то теплота переходить від тіла А до тіла В. При цьому температура тіла А зменшується, а температура тіла В збільшується. Якщо  , то тіла А и В перебувають у тепловій рівновазі, тому самовільного переходу теплового потоку між ними не буде.
, то тіла А и В перебувають у тепловій рівновазі, тому самовільного переходу теплового потоку між ними не буде.
Числове значення термодинамічної абсолютної температури можна визначити з рівняння (3.2) у вигляді:
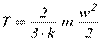
Таким чином, у термодинаміці температура розглядається як середньостатистична величина, що характеризує систему, яка складається з величезного (але кінечного) числа молекул, які знаходяться у хаотичному (тепловому) русі. Тому до одиничних молекул поняття температури застосувати не можливо.
Однак практично неможливо безпосередньо виміряти кінетичну енергію молекул газу. Тому температура вимірюється опосередковано за допомогою різних термометричних пристроїв (термометрів). У їхню основу покладене явище залежності від температури якої-небудь властивості речовини (теплового розширення, електричного опору, контактної ЕРС, теплового випромінювання та ін.), за величиною зміни якої судять про зміну температури.
Питомий об'єм робочого тіла (речовини) – це об'єм, який займає одиниця маси даної речовини, м 3 /кг
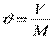 ,
,
де 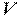 – об'єм тіла,
– об'єм тіла, 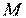 – його маса.
– його маса.
Величина, зворотна питомому об'єму, що визначає кількість речовини в одиниці об'єму, – густина робочого тіла – 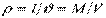 , кг/м 3,
, кг/м 3, 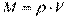 и
и 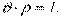
Питомий об'єм і густина також є статистичними усередненими величинами, тому що характеризують розподіл маси речовини по об'єму системи внаслідок хаотичного (теплового) руху молекул газу.
Одиниця густини в СІ – кг/м 3, СГС – г/см 3. Густина і питомий об'єм залежать від температури та тиску, тобто від термодинамічного стану речовини. Звичайно в довідковій літературі наводяться їхні значення при нормальних фізичних умовах 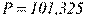 кПа (760 мм рт. ст.) і
кПа (760 мм рт. ст.) і 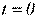 C.°
C.°
Отже, властивості руху системи, пов'язані з її станом, називають параметрами стану.
Будь-яка зміна параметрів стану є причиною (умовою) виникнення (наявності) термодинамічних процесів.
Термодинамічний процес – послідовна зміна стану тіла, що відбувається в результаті енергетичної взаємодії робочого тіла з навколишнім середовищем, яка характеризується обов'язковою зміною хоча б одного параметра стану. Розрізняють рівноважний процес, якщо в системі в кожен момент часу встигає установитися рівноважний стан (тобто процес, який протікає вкрай повільно), і процес нерівноважний, якщо він протікає з кінцевою швидкістю і викликає появу кінцевих різниць тисків, температур, густини і т.д.
Основні параметри стану системи, що перебуває в термодинамічній рівновазі, зв'язані між собою, причому число незалежних параметрів стану системи завжди дорівнює числу її термодинамічних ступенів свободи:
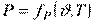 ,
, 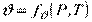 ,
, 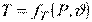 .
.
Таким чином, рівноважний стан термодинамічної системи повністю визначається значеннями двох незалежних змінних. У цьому випадку термодинамічна система називається простою системою або простим тілом. До простих тіл відносяться гази, пари, рідини і багато твердих тіл, що знаходяться у термодинамічній рівновазі.
В загальному випадку термодинамічні параметри поділяються на інтенсивні й екстенсивні: інтенсивні не залежать від розмірів і маси системи (тиск, температура, питомий і молярний об'єми, питома і молярна внутрішня енергія, питома і молярна ентальпія та ентропія); екстенсивні, пропорційні кількості речовини або масі даної термодинамічної системи (об'єм, маса, внутрішня енергія, ентальпія, ентропія та ін.). Основні параметри стану – інтенсивні.
Термодинамічні властивості (параметри), крім поділу на екстенсивні й інтенсивні, можуть бути класифіковані як термічні й калоричні властивості (величини). До термічних відносяться тиск 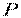 , об'єм
, об'єм 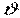 , температура
, температура 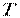 , а також термічні коефіцієнти (ізотермічний коефіцієнт стиснення, коефіцієнт об'ємного розширення і термічний коефіцієнт тиску).
, а також термічні коефіцієнти (ізотермічний коефіцієнт стиснення, коефіцієнт об'ємного розширення і термічний коефіцієнт тиску).
До калоричних властивостей відносяться такі термодинамічні величини, як ентропія 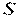 , внутрішня енергія
, внутрішня енергія 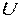 , ентальпія
, ентальпія 
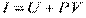 , вільна енергія
, вільна енергія 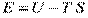 , ізобарно-ізотермічний потенціал
, ізобарно-ізотермічний потенціал 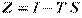 , теплоємність
, теплоємність 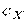 (
( 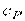 ,
, 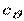 , ...).
, ...).
Дата добавления: 2021-06-28; просмотров: 749;











